Предлагаем вашему вниманию перевод статьи по проблеме применения глюкокортикоидных гормонов во время беременности. Даже кратковременное назначение глюкокортикоидов может на несколько десятилетий вперед "перепрограммировать" работу функциональных систем плода и оказать отрицательное воздействие на формирование поведения, контроль артериального давления и на регуляцию обмена веществ. Синтетический гормон "обманывает" организм плода, имитируя стрессовый сигнал со стороны организма матери, заставляя плод раньше времени форсировать мобилизацию резервов. В этом суть отрицательного действия этих препаратов. Это действие еще более усиливается в результате того, что современные "долгоиграющие" глюкокортикоиды (дексаметазон, метипред) не поддаются инактивирующему действию ферментных систем плаценты и оказывают продолжительное воздействие на органы и ткани-мишени. Оказывая иммуносупрессивное действие, эти препараты ослабляют организм беременной женщины по отношению к вирусным инфекциям.
Глюкокортикоидные гормоны должны применяться при беременности только тогда, когда польза от их применения значительно превышает возможный риск долговременных отрицательных последствий. К таким показаниям относится угроза преждевременных родов (глюкокортикоиды назначаются однократно или в виде очень короткого курса и позволяют значительно улучшить готовность недоношенного ребенка к самостоятельному существованию), активные аутоиммунные и ревматические заболевания (глюкокортикоиды позволяют резко снизить риск тяжелых осложнений у женщины) и врожденная внутриутробная гиперплазия коры надпочечников у плода (это наследственное заболевание, которое требует специальной антенатальной диагностики; применение глюкокортикоидов позволяет избежать вирилизации плода женского пола).
Авторы ничего не пишут о назначении глюкокортикостероидов с целью сохранения беременности. И это не случайно. На Западе подобное "лечение" было отвергнуто еще в конце 1950-х — начале 1960-х годов, поскольку не существует веских доказательств его эффективности. Развитие современных методов диагностики и лечения невынашивания беременности, в частности, в рамках иммунологии репродукции, не оставляет места подобной устаревшей практике.
Miodrag Dodic, Arianne Peers, John P. Coghlan, Marelyn Wintour — Trends in Endocrinology and Metabolism 1999, 10:86-91
На протяжении многих лет исследования, проводимые как на животных, так и на человеке, выявили зависимость поведения потомства от степени стрессового состояния матери и от воздействия глюкокортикоидов на плод в период внутриутробного развития. За последние 10 лет было получено значительное количество убедительных эпидемиологических данных о том, что замедление развития плода в матке является очень важным фактором риска возникновения сердечно-сосудистых нарушений и нарушений обмена веществ во взрослом возрасте. Позднее было показано, что очень важным, даже ключевым, моментом подобной предрасположенности является также воздействие на плод избытка глюкокортикоидов. Даже кратковременное (48 часов) применение дексаметазона на ранних сроках беременности может приводить к постоянному повышению артериального давления у взрослых овец. Понимание механизма подобного программирования и физиологических изменений, происходящих при этом, является одной из самых актуальных задач современной эндокринологии и биологии развития.
Многие годы определяющим фактором в развитии неинфекционных заболеваний во взрослом возрасте считалось воздействие неблагоприятных условий жизни и наличие генетической предрасположенности. Позднее было выдвинуто предположение о том, что самая первая окружающая среда, матка, в период внутриутробного развития человека, может играть даже более значимую роль, чем каждый из вышеперечисленных факторов. Это привело к созданию концепции "программирования", состоящей в том, что изменения внутриутробной среды, возникающие в определенные, ограниченные по времени периоды, может иметь отдаленные долговременные последствия и запускать цепь событий, приводящую к развитию функциональных нарушений во взрослом возрасте.
Концепция о влиянии внутриматочного окружения на дальнейшую судьбу потомства не так уж нова. Однако ранее проводимые исследования в этой области большее внимание уделяли влиянию внутриутробных воздействий на поведение новорожденного/подростка/взрослого. И если отмечались какое-либо отклонения, они рассматривались как поведенчески или психически обусловленные. Были проведены работы, посвященные связи состояния психического здоровья потомства с влиянием большого количества разнообразных "стрессов", испытываемых беременной. Эти "стрессы" включали в себя многократное воздействие громкого внезапного шума (например, на женщин, проживающих около аэропортов) или проживание в стране, готовящейся к войне, или ведущей войну (например, 6-дневная Израильская война). В этих случаях отмечалась задержка внутриутробного развития плода, трудности и/или замедление формирования двигательных, вербальных и социальных навыков. Исследования, проводимые на животных, были в основном сосредоточены на изучении влияния роли предполагаемых медиаторов этих нарушений — глюкокортикоидных гормонов надпочечников.
Около десяти лет назад эпидемиологические исследования, проводимые в Великобритании, стали выявлять взаимосвязь между низким весом ребенка при рождении и значительным возрастанием риска развития патологии сердечно-сосудистой системы во взрослом возрасте (до 20% после 45 лет). В дальнейшем подобная взаимосвязь была выявлена и для повышенного риска развития во взрослом возрасте нарушений обмена веществ — сахарного диабета 2-го типа и дислипидемии. Так называемая "гипотеза Баркера" состоит в том, что недостаточное питание женщины во время беременности приводит к задержке внутриутробного развития плода и запуску механизмов адаптации плода к недостаточному поступлению необходимых питательных веществ. При этом в физиологических системах плода возникают необратимые изменения, приводящие к развитию патологических состояний во взрослом возрасте.
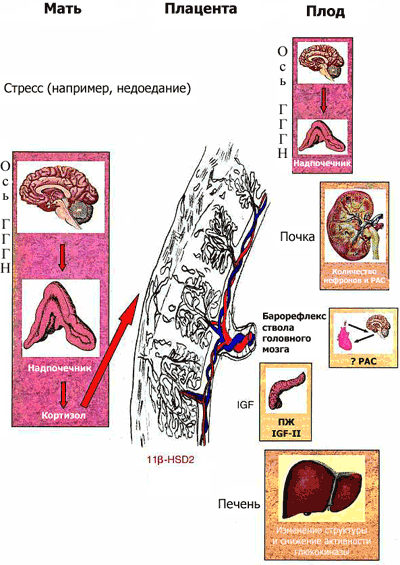 |
| Рис. 1 Потенциальные механизмы "программирования плода" Стресс материнского организма (например, недоедание во время беременности) приводит к активации оси гиппокамп-гипоталамус-гипофиз-надпочечники (ГГГН) у беременной, что, в свою очередь, в зависимости от уровня активности фермента плаценты, инактивирующего кортикостероиды (11 -гидроксистероиддегидрогеназы 2-го типа, 11 HSD-2), приводит к воздействию на плод высоких концентраций глюкокортикоидов (ГК). Высокий уровень глюкокортикоидов в крови плода способствует изменению числа стероидных рецепторов в ГГГН системе, изменяет уровень активности других функциональных систем (гормон роста /инсулин-зависимый фактор роста, ренин-ангиотензиновая система, вызывает замещение -клеток поджелудочной железы плода -клетками, характерными для взрослого организма), что в конечном итоге приводит к патологическим изменениям во взрослом возрасте. IGF II: инсулиноподобный фактор роста II; РАС: ренин-ангиотензиновая система; ПЖ: поджелудочная железа. |
К 1996 году взаимосвязь между патологией сердечно-сосудистой системы во взрослом возрасте и низким весом при рождении была выявлена в 34 исследованиях, охватывающих более, чем 60 000 наблюдений. В работах, проводимых Barker и коллегами, приводятся данные о том, что у людей,родившихся с массой тела менее 2,5 кг, в возрасте 50 лет и старше частота пульса в покое выше, чем у людей, весивших при рождении 3,3 кг и более. Это интерпретировалось, как доказательство влияния повышенной активности симпатической нервной системы, запрограммированное в периоде внутриутробного развития. Также было показано, что даже при наличии в покое нормального разброса значений кортизола плазмы, самые высокие значения отмечаются у людей, имеющих при рождении самую низкую массу тела. Подобная взаимосвязь была установлена и в отношении значений систолического артериального давления, уровня триглицеридов плазмы, степени инсулинорезистентности.
Эксперименты, проводимые на животных (морские свинки, крысы, овцы), подтвердили взаимосвязь между задержкой внутриутробного развития и формированием артериальной гипертензии или обменных нарушений во взрослом возрасте. Независимо от причины, приводящей к нарушению внутриутробного развития у животных (нарушение маточного кровотока, анемия у матери, недостаточно калорийное питание, либо низкобелковая диета во время беременности), результат получался один и тот же. Потомство крыс, получавших низкобелковую диету во время беременности и лактации, имело существенные изменения в морфометрии печени и значительное снижение активности глюкокиназы в перивенозных областях. В полученном потомстве морских свинок, имевших при рождении низкую массу тела, у молодых взрослых самцов развивалась артериальная гипертензия, отмечалось уменьшение объема мышечной ткани и увеличение жировой ткани, нарушение толерантности к глюкозе, нарушенный гомеостаз холестерина. Интереснее всего, что недостаточное питание в первой половине беременности у животных с большой продолжительностью беременности, как, например, овцы, приводило к рождению потомства, у которого к 3-х месячному возрасту развивалась артериальная гипертония.
Доказательства важной роли глюкокортикоидных гормонов в эмбриональном программировании системных заболеваний, развивающихся во взрослом возрасте, были получены из нескольких источников. Интерес к этим соединениям был вызван убедительными данными о том, что глюкокортикоиды могут непосредственно приводить к повышению артериального давления и формированию инсулинорезистентности во взрослом возрасте, а воздействие глюкокортикоидов во время беременности может замедлять развитие плода и перенастраивать состояние функциональной системы ГГГН во взрослом возрасте. Кроме того, в экспериментах на небеременных животных было отмечено, что недостаточное питание приводит к повышению активности гиппокамп-гипоталамо-гипофизарно-надпочечниковой системы. Дальнейшие исследования, включающие использование карбеноксолона (препарата, приводящего к подавлению плацентарной инактивации глюкокортикоидов), показали замедление внутриутробного развития потомства и повышение артериального давления во взрослом возрасте. Удаление надпочечников у беременных животных с использованием во время беременности только физраствора (0,9% NaCl) вместо питьевой воды, приводит к снижению веса потомства при рождении, но не к повышению артериального давления. При добавлении карбеноксолона к солевому раствору дальнейшего снижения веса при рождении не отмечалось, также не было отмечено повышения артериального давления. Использование метирапона у крыс в течение срока беременности 0-14 дней в сочетании с низко-белковой диетой привело к рождению потомства со сниженным весом, но с нормальным артериальным давлением в течение 7 недель после рождения. Замена метирапона на кортикостерон привела к повышению артериального давления после рождения только у женских особей.
Во многих исследованиях использовался синтетический стероид дексаметазон. Это было связано с тем, что дексаметазон не подвергается инактивации ферментом 11 -гидроксистероиддегидрогеназы 2-го типа (11 -HSD2). Данные исследования представляют интерес с точки зрения определения времени критического периода "программирования". Назначение беременным крысам дексаметазона только в течение последней трети гестационного периода привела к повышению кровяного давления у потомства через 16 недель после рождения. Назначение дексаметазона беременным овцам в течение всего лишь двух дней в конце первого месяца беременности (которая продолжается 5 месяцев) приводило к повышению кровяного давления у ягнят с 3-х месячного возраста. Повышение кровяного давления не было, если дексаметазон назначался в начале 3-го месяца беременности. Период назначения дексаметазона был настолько коротким, что снижения веса при рождении не происходило. Это согласуется с данными Hawkins, которые показали, что недостаточное питание овец только в первой половине беременности приводит к программированию ягнят на повышение кровяного давления к трехмесячному возрасту. Таким образом, полученные результаты показывают, что критические периоды "программирования" возможны как на ранних, так и на поздних этапах гестационного периода. Ранее это было показано для влияния андрогенов на формирование специфического для пола созревания нейро-эндокринной системы, но в отношении глюкокортикоидов это действие тогда не считалось заслуживающим внимания.
Теоретически во внутриутробном периоде под влиянием ряда неблагоприятных факторов могут происходить изменения многих органов и систем плода, приводящие к долговременным отдаленным последствиям во взрослом возрасте.
Функциональная система ренин-ангиотензин (ренин, ангиотензин, ангиотензинпревращающий фермент, рецепторы 1-го и 2-го типов) участвует в регуляции кровяного давления и представлена во многих органах плода (почки, головной мозг, сердечно-сосудистая система). Очевидна взаимосвязь между ренин-ангиотензиновой системой и функциональной системой поддержания уровня глюкозы в плазме крови. Было показано, что замедление внутриутробного развития плода особенно неблагоприятно влияет на развитие почек, а именно в виде уменьшения количества нефронов в активный период нефрогенеза и более высокими, чем в норме, концентрациями ренина и ангиотензина II в крови пуповины. Вследствие уменьшения количества нефронов повышается риск развития почечной недостаточности, что приводит к активизации ренин-ангиотензиновой системы с целью сохранения скорости клубочковой фильтрации. Предварительные данные участия ренин-ангиотензиновой системы получены в исследованиях L.G.Edwards и соавт., указывающих на то, что у ягнят, родившихся с низким весом в состоянии гипоксии, кровяное давление поддерживается на нормальном уровне за счет увеличения активности системы ренин-ангиотензин. Кратковременное (в течение 4 часов) введение каптоприла, приводящего к снижению продукции ангиотензина II, вызывает понижение кровяного давления у ягнят, родившихся с низким весом, но не у нормальных ягнят. У потомства крыс, получавших во время беременности недостаточное количество питательных веществ, использование каптоприла в период от 2 до 4 недель после рождения предотвращало развитие артериальной гипертензии. В исследованиях M. Dodic и соавт. у ягнят с артериальной гипертензией, развившейся вследствие применения дексаметазона на ранних сроках беременности, не было зарегистрировано сосудистой реактивности к экзогенному ангиотензину II в возрасте 5 — 19 месяцев. Тем не менее, тот факт, что ренин-ангиотензиновая система играет важную роль в установке барорефлекса, необходимого для поддержания нормального кровяного давления, не подвергается сомнению. В исследованиях M. Dodic у овец с артериальной гипертонией, развившейся в результате назначения дексаметазона в ранние сроки беременности, не было повышенной сосудистой реактивности на экзогенное введение ангиотензина II в возрасте 5—19 месяцев. Однако, ренин-ангиотензиновая система участвовует в настройке барорефлекса, обеспечивающего пределы колебаний артериального давления. M. Dodic и соавт. показали, что различие в значениях кровяного давления между группами ягнят, подвергавшихся и не подвергавшихся внутриутробному действию дексаметазона, увеличивается с увеличением возраста ягнят, и барорефлекс в основной группе перенастраивается. Предварительные результаты, показывающие, что показатели сердечного выброса у этих овец выше, чем в контрольной группе, хорошо согласуются с данной концепцией динамики барорефлекса.
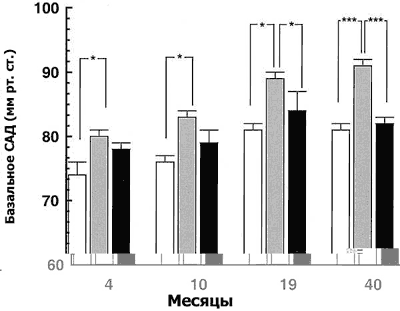 |
| Рис 2. Влияние пренатального использования глюкокортикоидов на цифры среднего артериального давления (САД) у потомства женского рода контрольной группы (n=7, светлый фон); ягнят, подвергшихся воздействию дексаметазона (0,48 мг в час в течение 48 часов при сроке беременности 27 дней (n=6, серый фон) и ягнят, подвергшихся воздействию дексаметазона (0,48 мг в час в течение 48 часов при сроке беременности 64 дня (n=7, темный фон) в возрасте 4, 10, 19 и 40 месяцев. (M.Dodic и соавт.) |
В проводимых исследованиях получено большое количество доказательств, свидетельствующих о том, что материнский стресс во время беременности или воздействие избытка глюкокортикоидов приводит к изменениям в структурах головного мозга плода (ствол головного мозга, гиппокамп, гипоталамус, неокортекс). У потомства крыс, подвергшихся воздействию дексаметазона на сроках 17-19 дней беременности, обнаружено снижение количества норадреналина в неокортексе и гиппокампе в возрасте 14 недель и изменения обмена серотонина в гипоталамусе, гиппокампе и неокортексе с возраста 3 недель. Подобные нарушения содержания и/или обмена нейротрансмиттеров выражались в изменении поведения (повышенная возбудимость), более высоком уровне кортикостерона плазмы при попадании в незнакомое окружение. У потомства зеленых мартышек, подвергшихся однократному воздействию дексаметазона во второй половине беременности, с помощью ядерного магнитного резонанса было обнаружено уменьшение объема гиппокампа на 20-30% в возрасте 20 месяцев. Кроме того, у данной группы мартышек был обнаружен закономерно более высокий уровень кортизола плазмы (в утренние, дневные часы, после стресса), чем в контрольной группе.
Согласно существующей теории состояние настройка гиппокамп-гипоталамо-гипофизарно-надпочечниковой системы может быть нарушена изменением количества и/или аффинности рецепторов глюкокортикоидов в результате действия механизма "программирования". В дальнейшем это приводит к более высокой, чем в норме, секреции глюкокортикоидов во взрослом возрасте. Длительное воздействие повышенного уровня глюкокортикоидов способствует развитию артериальной гипертензии и увеличивает риск развития сахарного диабета 2-го типа. Современные исследования на животных показывают, что у потомства овец, получавших недостаточное питание в первой половине беременности, отмечалались ослабленная ответная реакция ГГГН системы на гипоксию или на экзогенный кортикотропин-рилизинг гормон во внутриутробном периоде, но усиленный ответ на те же стимулы после рождения.
В настоящее время известно, что под действием глюкокортикоидов -клетки поджелудочной железы плода подвергаются апоптозу (программируемой гибели) на определенной критической стадии внутриутробного развития (у человека на сроке 28-32 недели беременности, у крыс на 7-14 сутки послеродового периода) и заменяются -клетками, характерными для взрослого организма. В этом процессе участвует система инсулин-подобных факторов роста.
Хотя дексаметазон широко используется, как глюкокортикоид, его эффекты не ограничиваются действием только на классические глюкокортикоидные рецептор . В исследованиях, проводимых много лет назад, было обнаружено, что рецептор, связывающий дексаметазон в тканях быка, не является классическим рецептором глюкокортиоидов. Не так давно был открыт Х рецептор прегнана (PXR), который не связывал естественные глюкокортикоиды (кортизол, кортикостерон), но связывал дексаметазон, прогестерон, прегненолон и некоторые их производные. В виде димера с рецептором 9-цис-ретиноевой кислоты, PXR связываетсясо специфическими сайтами ДНК, состоящими из двух повторяющихся последовательностей. Потенциально активные нейростероиды, такие как аллопрегнанолон и тетрагидродеоксикортикостерон, образуются в организме под действием 5 -редуктаз, особенно под действием гидроксистероид-дегидрогеназ типов 2 и 3 . Ген 5 -редуктазы типа 2 транзиторно экспрессируется в мозге крысы в поздние сроки беременности и в раннем постнатальном периоде. Экспрессия 3 -редуктаз индуцируется дексаметазоном, действующим не на классические рецепторы глюкокортикоидов. Образующиеся после индукции данных ферментов нейростероиды могут влиять на многие аспекты дифференцировки и созревания головного мозга, связанные со становлением эндокринных и поведенческих функций, взаимодействуя с рецепторами ГАБА, никотиновыми рецепторами ацетилхолина, рецепторами N-метиласпартата и, возможно, с мембранными стероидными рецепторами. Нейростероиды типа аллопрегненолона оказывают влияние на становление барорефлекса. Эти данные открывают новые горизонты для дальнейших исследований влияния приема глюкокортикоидов на созревание функциональных систем плода.
За последние 20 лет значительно снизилась смертность среди недоношенных новорожденных (24-26 недель), что во многом связано с использованием в терапии глюкокортикоидов при возникновении угрозы преждевременных родов назначением сурфактанта после рождения. Если удавалось избежать преждевременных родов, то часто проводились повторные курсы введения глюкокортикоидов. Возникают сомнения, не оказывают ли повторяющиеся инъекции глюкокортикоидов неблагоприятного побочного действия на плод. Опыты на животных (овца) показали, то повторные курсы глюкокортикоидов могут приводить к задержке миелинизации аксонов зрительного нерва. Это позволяет заподозрить возможное повреждающее действие глюкокортикоидов на центральную нервную систему плода. У детей, матери которых во время беременности длительно получали низкие дозы глюкокортикоидов, с целью снижения риска развития проявлений врожденного адреногенитального синдрома отмечались определенные нарушения поведения. Даже при условии, что пренатальное лечение ГК эффективно в устранении вирилизации у плодов женского пола с врожденной надпочечниковой гиперплазией, только в одном из восьми случаев можно расчитывать на возможный положительный эффект от такого лечения. Учитывая материал данного обзора, рекомендуются ограничить до минимума использование ГК во время беременности.
Данный обзор подчеркивает важность того, что беременная женщина должна правильно питаться и быть в психологически комфортном состоянии. Но многие проблемы еще ждут своего решения.
 |
| Рис. 3. Будущая мама должна хорошо питаться и чувствовать себя спокойно. |
Насколько сильным должен быть стрессовый фактор, чтобы привести к повышенному риску возникновения у потомства сердечно-сосудистых и обменных нарушений? Данные определения гормонов во время беременности пока что недостаточно убедительны и противоречивы. Каковы точные сроки критических периоды "программирования"? Сколько таких периодов в течение беременности? Обладают ли и другие гормоны коры надпочечников, а не только глюкокортикоиды, нежелательным действием на плод? Могут ли оказывать вредное действие на плод минералокортикоиды? Было показано, что больные, унаследовавшие гиперальдостеронизм от матери, имели более высокие уровни альдостерона плазмы, чем те, кто унаследовал гиперальдостеронизм от отца. Предполагается, что эти люди подвергались воздействию повышенных уровней альдостерона внутриутробно. Недавно была показана связь между количеством висцерального жира и повышенным уровнем альдостерона плазмы. Увеличение количества висцерального жира является частью синдрома X, риск развития которого в 10 раз выше в группе новорожденных с низкой массой тела при рождении. Хроническое воздействие альдостерона может быть причиной развития артериальной гипертензии. Альдостерон так же, как и глюкокортикоиды может изменять экспрессию мРНК минералокортикоидных и глюкокортикоидных рецепторов в гиппокампе.
Каковы механизмы индукции патологических изменений? Есть ли маркеры выявления детей повышенного риска развития неблагоприятного программирования? Как нужно лечить детей с низкой массой тела при рождении, чтобы снизить риск развития артериальной гипертонии и/или обменных нарушений спустя 40 лет?
Задать вопрос врачу на форуме