В основе многих видов акушерской патологии лежит развитие генерализованной микроангиопатии и тромбофилии. Их причинами могут быть антифосфолипидный синдром (АФС), гипергомоцистеинемия, наследственные дефекты гемостаза. Сочетание этих факторов значительно повышает риск развития осложнений беременности. Это наглядно демонстрирует клинический случай сочетания АФС, гомозиготной формы мутации MTHFR T677C и гипергомоцистеинемии. Своевременная коррекция гипергомоцистеинемии как дополнительного фактора риска позволила предотвратить развитие тяжелого гестоза. Во время двух предыдущих беременностей у данной пациентки тяжелый гестоз стал причиной преждевременных искусственных родов, операции кесарева сечения и рождения нежизнеспособных плодов. Учитывая значимость гипергомоцистеинемии как фактора риска развития осложнений второй половины беременности, представляется целесообразным своевременная диагностика и коррекция этого состояния во время беременности.
Many of the obstetrics complications during pregnancy are caused by general microangiopathy and thrombophilic conditions caused by the antiphospholipid syndrome (APS), hyperhomocysteinaemia and hemostasis defects. The association of these factors significantly increases the risk of obstetric complications. The reported case demonstrates the key role of hyperhomocysteinaemia as an additional risk factor in a patient with APS. The timely diagnosis and treatment of hyperhomocysteinaemia has prevented the development of severe preeclampsia in a woman who had gone twice under the artifitious preterm labor (once operative) during previous pregnancies on 32 and 28 weeks of gestation because of high level of hypertension and proteinuria. Early diagnosis of hyperhomocysteinaemia seems to be important in high risk pregnancies.
Ключевые слова: антифосфолипидный синдром, беременность, гестоз, гомоцистеин, наследственные тромбофилии.
Тяжелые осложнения второй половины беременности (преэкламспия, эклампсия, отслойка плаценты, внутриутробная гибель плода) являются одними из самых опасных акушерских осложнений. Во многих случаях тяжесть состояния (высокий уровень артериальной гипертензии и протеинурии, судорожный синдром) и быстрое прогрессирование патологического процесса заставляет врачей преждевременно прерывать такую беременность ради спасения жизни женщины. При этом дети, рожденные раньше срока, нередко оказываются в тяжелом состоянии из-за длительного внутриутробного страдания вследствие фетоплацентарной недостаточности и гипоксии и, несмотря на весь комплекс проводимых мероприятий реанимации и интенсивной терапии, не способны адаптироваться к условиям внеутробного существования. В результате семья может остаться без желанного ребенка, а женщина, в случае проведения оперативных родов, - с рубцом на матке после операции кесарева сечения - самостоятельным фактором риска развития осложнений в последующие беременности.
Важно подчеркнуть, что рутинное обследование вне и на ранних сроках беременности (общеклинические анализы крови, мочи, скрининговые гормональные исследования и обследование на ЗППП), как правило, не выявляет серьезной патологии у таких пациенток.
Исследования последних лет показали, что в основе многих видов акушерской патологии лежит развитие генерализованной микроангиопатии и тромбофилии, связанных с аутоиммунными нарушениями (включая антифосфолипидный синдром), гипергомоцистеинемией, наследственными дефектами гемостаза (10), (13). Клиническими проявлениями этих патологических состояний могут быть раннее начало и/или тяжелое течение гестоза, фетоплацентарная недостаточность, внутриутробная задержка развития плода (ВЗРП), отслойка плаценты, внутриутробная гибель плода (14).
Во многих случаях каждый из названных этиопатогенетических факторов в отдельности может не сопровождаться патологическим течением беременности. Однако их сочетание приводит к значительному снижению адаптационных способностей организма женщины к условиям гестации и может стать своего рода "триггером" в каскаде патологических реакций развития генерализованной микроангиопатии и тромбофилии (12), (14). Отсюда у женщин, имеющих сочетание этих факторов, вероятен высокий риск нарушений плацентации и, как следствие этого, развитие привычного невынашивания, плацентарной недостаточности, ВЗРП, позднего токсикоза (гестоза), состояний, угрожающих по отслойке плаценты, акушерским кровотечениям, внутриутробной гибели плода.
Одним из вариантов решения проблемы профилактики и ранней диагностики указанных состояний может стать выявление дополнительных факторов риска развития тромбофилий, изучение возможных вариантов их сочетания и взаимного влияния друг на друга, формирование групп риска по развитию осложнений второй половины беременности и поиск надежных маркеров и новых эффективных способов коррекции выявляемых отклонений.
Примером, характеризующим решающее участие гомоцистеина в развитии осложнений второй половины беременности, может служить клинический случай больной К., 1970 года рождения.
Из анамнеза: первая беременность в возрасте 23 лет (1993 г.). Наступила самопроизвольно. Первый и начало второго триместра протекали без осложнений с явлениями токсикоза легкой степени. Однако на 25-26 неделе беременности внезапно появились первые признаки позднего токсикоза: артериальная гипертензия 130/90 мм рт. ст. и протеинурия, в связи с чем пациентка была госпитализирована. В отделении патологии беременности проводилась терапия гестоза: курантил 3т./сут., клофелин 1т/день, эуфиллин 3т./сут., внутривенные инфузии раствора гемодеза, реополиглюкина. Несмотря на проводимую терапию, состояние беременной значительно ухудшилось, и в 32 недели в связи с нарастанием тяжести гестоза (протеинурия до 6,6 ., артериальная гипертензия до 160/100 мм рт.ст) и неэффективностью проводимого лечения было решено прервать беременность. Искусственно были вызваны преждевременные роды. Родился недоношенный гипотрофичный ребенок, который погиб вскоре после родов. Послеродовой период протекал без осложнений.
Перед планированием второй беременности пациентка прошла обследование с целью исключения соматической патологии, которая могла бы ухудшить прогноз течения беременности и способствовать раннему началу и тяжелому течению позднего токсикоза. В результате обследования серьезные нарушения со стороны здоровья женщины выявлены не были. Противопоказаний для повторной беременности нет.
Вторая беременность в 28 лет (1998 г.). Первый и начало второго триместра беременности протекали без осложнений. Однако в "критические" для данной пациентки сроки (25-26 неделя беременности) вновь появились первые признаки позднего токсикоза: повышение артериального давления до 125/85 мм рт. ст. и протеинурия 0,091.. Учитывая отягощенный акушерский анамнез и исход предыдущей беременности, больная была направлена на стационарное лечение. В отделении патологии беременности было проведено комплексное обследование, которое позволило диагностировать сочетанный гестоз II половины беременности на фоне хронического пиелонефрита, нейроциркуляторной дистонии по гипертоническому типу, анемии. Были начата активная терапия: уросептики, курантил, аспирин, клофелин, внутривенные инфузии раствора гемодеза, реополиглюкина, свежезамороженной плазмы. Несмотря на весь комплекс проводимых лечебных мероприятий, патологические изменения прогрессировали еще быстрее, чем в предыдущую беременность: отмечалось нарастание протеинурии до 13,2., артериальной гипертнезии до 160/100 мм рт. ст. На 27-28 неделе беременности в экстренном порядке была произведена операция кесарева сечения; извлечен живой недоношенный мальчик, массой 1000 г, длиной 40 см, в тяжелом состоянии, умер на следующие сутки после родов.
В период с 1998 г. по 2000 год пациентка проходила обследование в терапевтических и акушерско-гинекологических клиниках г. Москвы. В результате этого обследования был диагностирован хронический пиелонефрит, по поводу которого проводилось несколько курсов антибактериальной терапии. По окончании курсов антибактериальной терапии, нефрологами было дано заключение, что противопоказаний для беременности нет. Гормональное обследование на причины невынашивания беременности отклонений не выявило. Однократно по результатам гемостазиограммы был отмечен положительный волчаночный антикоагулянт (ВА). Однако дальнейшего обследования на антифосфолипидный синдром проведено не было. Специального лечения не назначалось.
С результатами обследования, в ходе которого не было выявлено существенных отклонений, которые можно было бы рассматривать как факторы риска развития осложнений беременности, в декабре 2000г. пациентка обратилась в Центр иммунологии и репродукции г. Москвы.
Положительный тест на ВА заставил провести дополнительное обследование на АФС. При первичном обращении было выявлено повышение уровня антикардиолипинов (АКЛ): IgG 48.0 gPL (при норме < 20 gPL) и АКЛ IgM 29.8 mPL (при норме 23mPL). По данным коагулограммы на момент поступления: тромбоциты - 180 (норма 180-320х10*9), агрегационная активность не превышала 70% на индуктор АДФ и 65% на индуктор адреналин; протромбин - 95% (норма 70-105); АТ-III - 101% (при норме 80-120%); плазминоген в пределах нормы, концентрация РКМФ менее чем в 2 раза превышала норму. Было решено начать подготовку к беременности с учетом наличия признаков антифосфолипидного синдрома.
С современных позиций высокий уровень антикардиолипинов приводит к активации свертывания крови и отложения фибрина в ворсинах хориона. Принимая во внимание, что АФС сам по себе может вызывать серьезные осложнения в течение беременности и нарушать процессы формирования и функции плаценты с момента нидации плодного яйца в подготовленную слизистую оболочку матки, было проведено обследование на дополнительные иммунологические факторы, которые тем или иным образов также могут влиять на этот процесс:
Терапия АФС рекомендована согласно международным стандартам ведения беременных с АФС: аспирин в малых дозах, инъекции гепарина, внутривенные инфузии раствора иммуноглобулина человеческого нормального (IVIg) (1),(9), (11). Опыт Центра иммунологии и репродукции также отмечает достаточно высокую эффективность сочетания стандартной аспирино- и гепаринотерапии с IVIg каждый месяц под контролем показателей гемостазиограммы и уровня аутоантител. Иммуноглобулины оказывают неспецифическое иммуномодулирующее действие на иммунную систему, снижая активность аутоиммунных реакций, с одной стороны, и действуя как антиидиотипические антитела по отношению к АКЛ - с другой. Исходя из этого, за месяц до планирования беременности пациентке была начата аспиринотерапия (50 мг/сут. с увеличением дозы до 75 мг/сут. с наступлением беременности), IVIg каждый месяц, с цикла планирования зачатия - гепаринотерапия (подкожное введение 5000 ед. каждые 12 часов) - под контролем гемостазиограммы.
Первый триместр беременности протекал без осложнений. Отмечались явления токсикоза легкой степени (тошнота, редко - рвота), артериальное давление сохранялось в пределах 100/70 - 110/80 мм рт. ст., лишь однократно в общем анализе мочи - протеинурия (0.08 .). При консультации нефролога данных за обострение хронического пиелонефрита получено не было. На фоне проводимой терапии на 10-11 неделе беременности уровень аутоантител: составил: АКЛ IgM 7,7 mpL и IgG 9,7 gpL . В 16 недель беременности было выполнено УЗИ - показатели течения гестационного процесса в норме.
Однако, несмотря на проводимую терапию антифосфолипидного синдрома, с 23 - 24 недели беременности пациентка стала отмечать периодические головные боли, в анализах мочи несколько раз были определены следы белка, появилась тенденция к повышению систолического артериального давления (до 125 мм рт. ст. при рабочем систолическом давлении 100 - 110 мм рт. ст.). На 22-й неделе беременности уровень антифосфолипидных антител: АКЛ IgM 10,8 mpL и IgG 21,7 gpL. По данным коагулограммы - умеренная гиперфибриногенемия 6,1 г/л (N 2-4 г/л), повышение паракоагуляционного теста.
Обращает на себя внимание тот факт, что несмотря на появление симптомов позднего токсикоза (протеинурии, артериальной гипертензии) в "критические" для данной пациентки сроки во время описываемой беременности, в целом ситуация значительно отличалась от происходившего в первую и вторую беременности на аналогичных сроках. В предыдущие беременности признаки гестоза появлялись внезапно, были гораздо более выраженными и, что особенно важно, достаточно быстро нарастали, приводя к угрожающей ситуации для жизни пациентки, что заставляло врачей преждевременно прерывать беременность, в первом случае вызывая искусственные роды, во втором - путем операции кесарева сечения в экстренном порядке. В данном случае на фоне проводимой терапии появились лишь микросипмтомы нарушения течения гестационного процесса. Тем не менее, даже незначительная выраженность протеинурии (следы белка в анализах мочи) и артериальной гипертензии (максимальный подъем систолического артериального давления до 125 мм. рт. ст.) заставил провести поиск дополнительных факторов риска, способствующих повреждению сосудистой стенки и развитию позднего токсикоза. Были выполнены ПЦР-диагностика наследственных тромбофилий (мутация гена фактора V Leiden, мутация гена протромбина G202110А, мутация гена метилентетрагидрофолатредуктазы (MTHFR) С677Т) и определение уровня гомоцистеина в крови. В результате проведенного дообследования были диагностированы повышенный уровень общего гомоцистеина в крови - 27,12 мкг/л (при норме 8-10 мкг/л) (рис. 1) и гомозиготная форма мутации гена MTHFR С677Т.
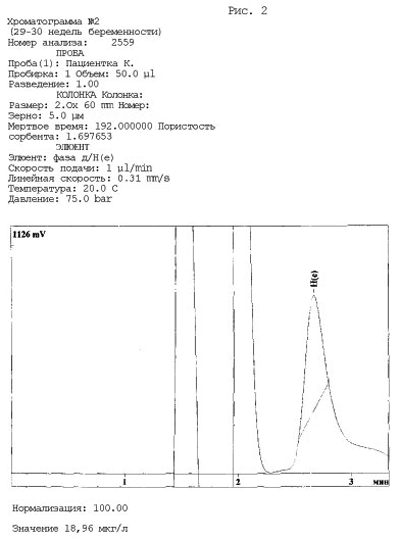
Частота гомозиготной формы мутации MTHFR C677T в популяции составляет 10%. Это нередкая форма мутации, поэтому она не может рассматриваться как самостоятельный и единственный фактор риска (12). Однако, сочетание высокого уровня АКЛ и мутации MTHFR C677T, приводящей к гипергомоцистеинемии, в десятки раз повышает риск развития тромбофилических осложнений беременности. После диагностики умеренной гипергомоцистеинемии пациентке был рекомендован к проведению курс витаминотерапии: в/м инъекции растворов витамина В6 (первые 5 инъекций по 100 мг/сут., следующие 5 инъекций по 50 мг/сут.) и витамина В12 (10 инъекций по 500 мг/сут.) в режиме их введения через день на протяжении 3 недель на фоне дополнительного приема фолиевой кислоты (5 мг/сут. с постепенным снижением дозы до поддерживающей - 1 мг/сут.). По завершении курса были определены концентрация общего гомоцистеина в крови (18,96 мкг/л) (рис. 2), уровень АКЛ (IgG 7,7 gPL и АКЛ IgM 9,7 mPL ). По данным коагулограммы - умеренная гиперфибриногенемия 5,7 г/л (N 2-4 г/л), повышение паракоагуляционного теста. С 33 недели беременности пациентке был проведен еще один курс дополнительного приема фолиевой кислоты по следующей схеме: 1-я неделя - 4 мг/ сутки, 2-я неделя -3 мг/ сутки, 3-я - 2 мг/сутки и по 1 мг фолиевой кислоты до конца беременности.
На 34 неделе беременности контролируемые лабораторные показатели были следующими: АКЛ IgM 5,5 mpL IgG 5,7 gpL. Концентрация гомоцистеина снизилась почти до нормы (14,94 мкг/л) (рис. 3). По данным коагулограммы - умеренная гиперфибриногенемия 5,9 г/л (N 2-4 г/л), повышение паракоагуляционного теста.
Следует отметить, что показатели исследований, позволяющих оценить внутриутробное состояние плода: кардиотокограммы, доплерометрии и УЗИ, - проведенных на 31-32 и 33-34 неделях беременности, были в пределах нормы. Выраженного отставания во внутриутробном развитии плода выявлено не было. Впервые признаки внутриутробной задержки роста плода (ВЗРП) были отмечены на 36 неделе беременности, когда пациентка была заранее госпитализирована для подготовки к родоразрешению.
Беременность закончилась родами путем операции кесарева сечения в срок доношенной беременности. Родилась живая девочка, масса 2800 г, рост 49 см (гипотрофия I степени), оценка по шкале Апгар 8 - 8 баллов. Осложнения со стороны родильницы и плода в послеродовом периоде не отмечались.
Гипергомоцистеинемия и антифосфолипидный синдром являются самостоятельными факторами риска повреждения эндотелия с последующей активацией внутрисосудистого свертывания крови, что может быть причиной развития осложнений беременности, в частности раннего начала и тяжелого течения гестоза (1),(4), (8), (12). Вероятно, сочетание факторов значительно повышает этот риск.
Данной случай позволяет сделать вывод о взаимном потенцировании АФС и гипергомоцистеинемии, что может значительно ухудшать течение беременности. Важно обратить внимание на то, что причиной развития гипергомоцистеинемии у данной пациентки явилась не только гомозиготная форма мутации MTHFR T677C, но также нарушение усвоения витаминов, т.к. прием поливитаминного комплекса для беременных, содержащий адекватное количество фолиевой кислоты и витаминов группы В, оказался недостаточным для поддержания нормального уровня гомоцистеина крови. Обеспечение поступления дополнительной дозы витаминов группы В парентерально и фолиевой кислоты в конечном итоге позволило создать условия для нормализации уровня гомоцистеина и предотвратить развитие выраженной генерализованной микроангипатии, лежащей в основе гестоза.
Данный случай сочетания АФС и гипергомоцистеинемии наглядно демонстрирует важность расширенного поиска факторов риска развития осложнений второй половины беременности у пациенток с отягощенным акушерским анамнезом: несмотря на адекватное (по международным стандартам) ведение пациентки с АФС не удалось полностью предотвратить появление позднего токсикоза и внутриутробной задержки роста плода. Лишь дополнительная диагностика и коррекция гипергомоцистеинемии позволила стабилизировать клинические показатели и создать более благоприятные условия для продолжения беременности и развития плода.
Важно обратить внимание врачей на тот факт, что у пациенток с незаподозренной гипергомоцистеинемией стандартная терапия, применяемая в стационарах и направленная на устранение проявлений гестоза, может оказаться не только неэффективной, но в какой-то мере может даже ухудшить ситуацию. Это касается таких препаратов, как метионин, эуфиллин, достаточно часто применяемых для лечения и профилактики фетоплацентарной недостаточности и позднего токсикоза. Прием метионина и эуфиллина достоверно приводит к повышению уровня гомоцистеина крови (5), что может включить или дополнить каскад патологических реакций, приводящих к развитию генерализованной микроангиопатии и тромбофилических состояний.
Коррекция вовремя заподозренного и диагностированного дополнительного фактора риска развития тромбофилических осложнений беременности - гипергомоцистеинемии и гомозиготной формы мутации MTHFR T677C - лежащих в основе развития фетоплацентраной недостаточности (как хронической, так и острой), позволила предотвратить развитие тяжелого гестоза, который у данной пациентки в предыдущие беременности служил показанием к их преждевременному прерыванию.
В настоящее время в Центре наблюдается несколько пациенток со схожим акушерским анамнезом - тяжелыми осложнениями второй половины беременности. В результате обследования у них были выявлены различные варианты сочетания высокого уровня АКЛ, гипергомоцистеинемии и наследственных дефектов гемостаза.
Учитывая значимость гипергомоцистеинемии как фактора риска развития осложнений второй половины беременности, Центр иммунологии и репродукции рекомендует определение уровня гомоцистеина следующим группам пациенток: