Преэклампсия – это тяжёлое осложнение второй половины беременности, сопровождающееся повышением артериального давления и появлением белка в моче. Основной причиной развития преэклампсии во время беременности является нарушение процессов формирования плаценты в сроке до 16 недель гестации. Преэклампсия является четвертой по частоте причиной материнской смертности, фактором риска развития у матери после родов заболеваний сердечной-сосудистой системы, почек, органа зрения, метаболических нарушений. Развившаяся преэклампсия во время беременности в тяжелых её вариантах является показанием к досрочному родоразрешению женщины, рождению глубоко недоношенного ребёнка, повышая частоту перинатальной заболеваемости и смертности. В настоящий момент не существует эффективных методов лечения преэклампсии за исключением родоразрешения, поэтому крайне важным является профилактика этой патологии. Основным методом профилактики преэклампсии является приём низкодозированного аспирина женщиной с этапа предгравидарной подготовки и ранних сроков беременности у женщин из группы высокого риска, а также у женщин с 12-13 недель беременности при повышенном риске преэклампсии по данным первого пренатального скрининга.
Специалисты нашего центра имеют многолетний опыт работы с беременными группы высокого риска, в том числе, после преэклампсии.
Определение
Преэклампсия – это патологическое состояние, возникающее во время беременности (после 20 недель), в родах и послеродовом периоде и характеризующееся наличием артериальной гипертензии и значительной протеинурии.
Частота развития преэклампсии во время беременности достаточно высока и составляет примерно 3-4%. При этом, развившаяся преэклампсия угрожает здоровью и жизни матери и плода.
Основной причиной развития преэклампсии, особенно ранней преэклампсии, развивающейся до 34 недель беременности, является нарушение процессов плацентации, то есть формирования плаценты.
Это стойкое повышение систолического артериального давления выше 140 мм рт.ст., а диастолического артериального давления выше 90 мм рт.ст.
Наличие белка в моче.
Для преэклампсии характерна значительная протеинурия > 0,3 г в суточной моче или 0,3 г/л в двух порциях мочи, взятых с интервалом более 6 часов.
В настоящий момент принята классификация американского общества акушеров-гинекологов (ACOG), включающая две степени тяжести преэклампсии – умеренную и тяжёлую преэклампсию, а также эклампсию (развитие судорог). В литературе можно встретить и другое название этого осложнения – «гестоз», которое в настоящий момент не употребляется.
Плацентация
Плацента – это орган, который формируется только во время беременности и позволяет развиваться плоду в организме матери на протяжении всего периода беременности.
Плацента осуществляет огромное количество функций во время беременности, в том числе:
- Питательную:
- транспорт питательных веществ плоду.
- Дыхательную:
- транспорт кислорода плоду.
- Транспортная:
- транспорт продуктов обмена.
- Гормональную:
- синтез ХГЧ, обеспечивающего поддержание функции жёлтого тела и выработку прогестерона;
- синтез плацентарного лактаген;
- синтез серотонина, релаксина и других биологически активных веществ.
- Защитную:
- обеспечение иммунологической толерантности к плоду (плод, имеющий половину генов от отца не отторгается организмом матери);
- транспорт защитных антител от матери к плоду, защита от чужеродных микроорганизмов.
Плацента образуется последовательно в 3 этапа:
- Трофобласт.
- Хорион.
- Плацента.
Трофобласт – это наружный слой клеток зародыша, который формируется на стадии поздней бластоцисты на пятый-седьмой дни после оплодотворения и обеспечивает процесс имплантации бластоцисты в эндометрий.
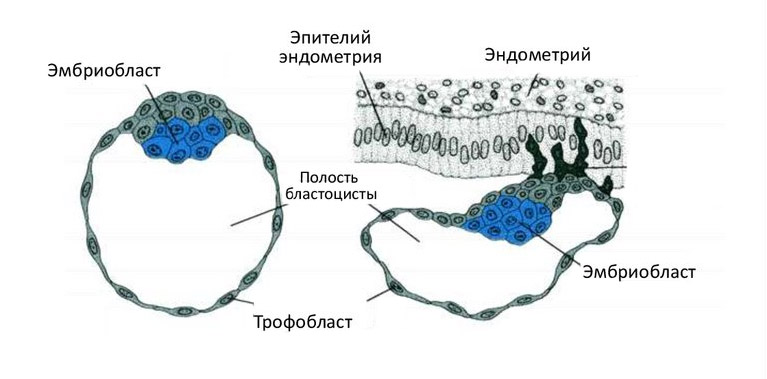
В процессе имплантации трофобласт делится на цитотрофобласт (внутренний слой) и синцитиотрофобласт (наружный слой).
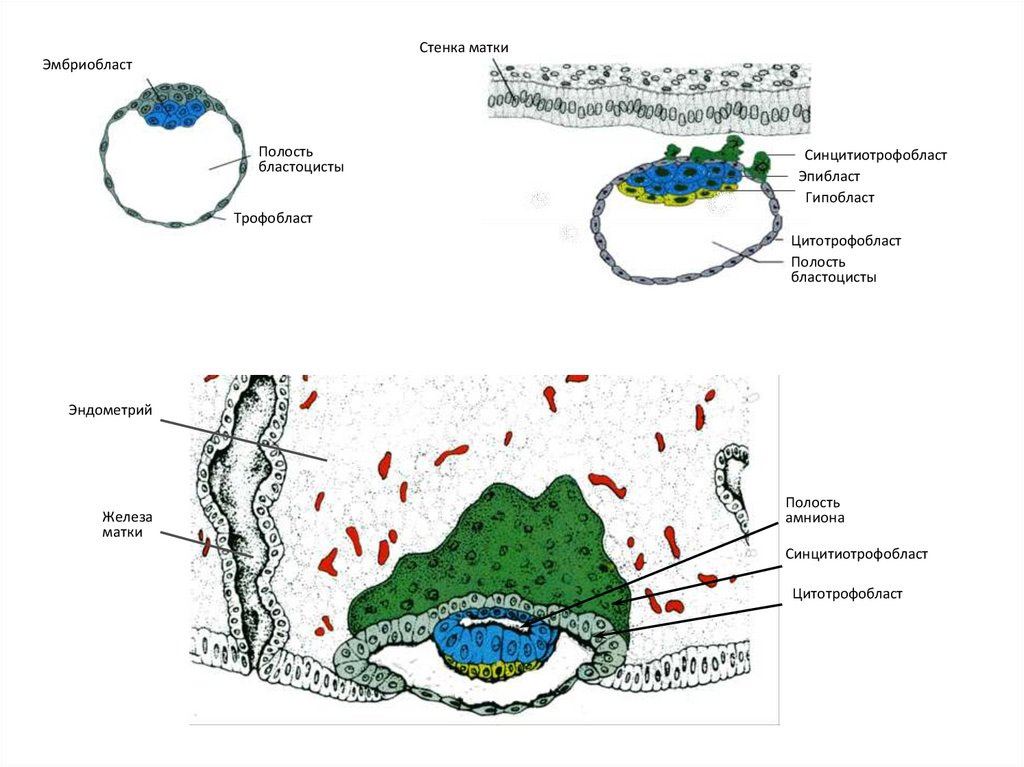
В дальнейшем трофобласт образует выпячивания внутрь эндометрия – ворсины, после чего начинает называться ворсинчатым хорионом. Впоследствии внутри ворсин образуются кровеносные сосуды, которые соединяются с сосудами эмбриона.
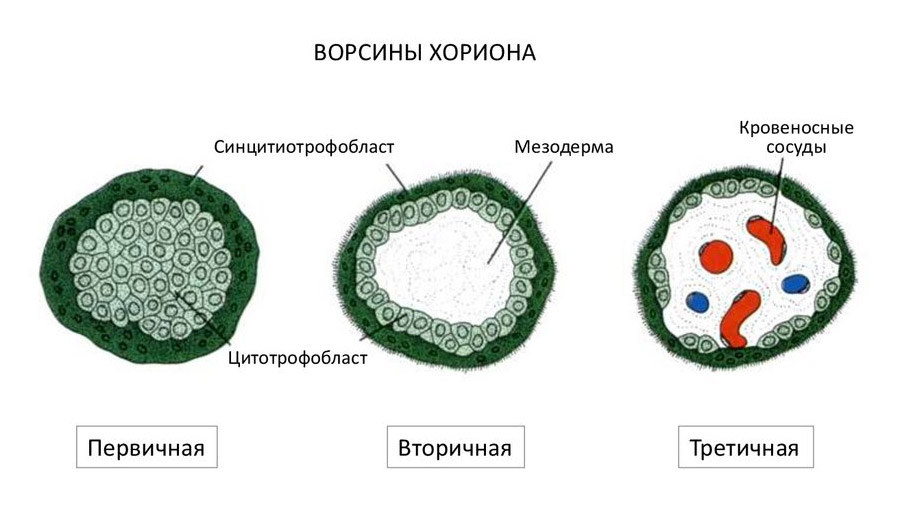
Участок хориона, обращенный к полости матки, теряет ворсинки к восьмой неделе беременности и называется гладким хорионом.
В ходе погружения в слизистую оболочку матки, ворсины хориона активно растут, разветвляются.
Кровь матери не смешивается с кровью плода, а питание происходит за счет диффузии питательных веществ и кислорода из крови матери, поступающей по спиральным артериям в межворсинчатое пространство.
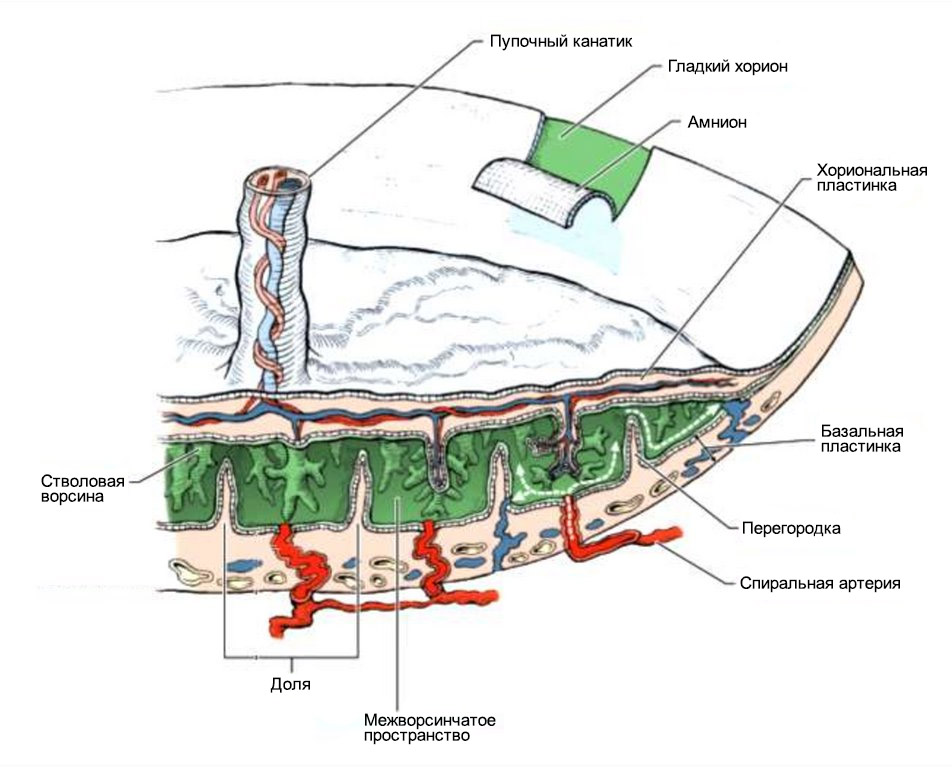
Также в плаценте существует так называемый вневорсинчатый цитотрофобласт (ворсинчатый выстилает изнутри ворсинки хориона). Вневорсинчатый цитотрофобласт играет огромную роль в процессе формирования плаценты. Клетки вневорсинчатого цитотрофобласта проникают в стенки спиральных артерий и вызывают так называемое ремоделирование спиральных артерий.
Глубина инвазии вневорсинчатого цитотрофобласта (по отношению к толщине миометрия – мышечного среднего слоя матки) определяют степень ремоделирования спиральных артерий.
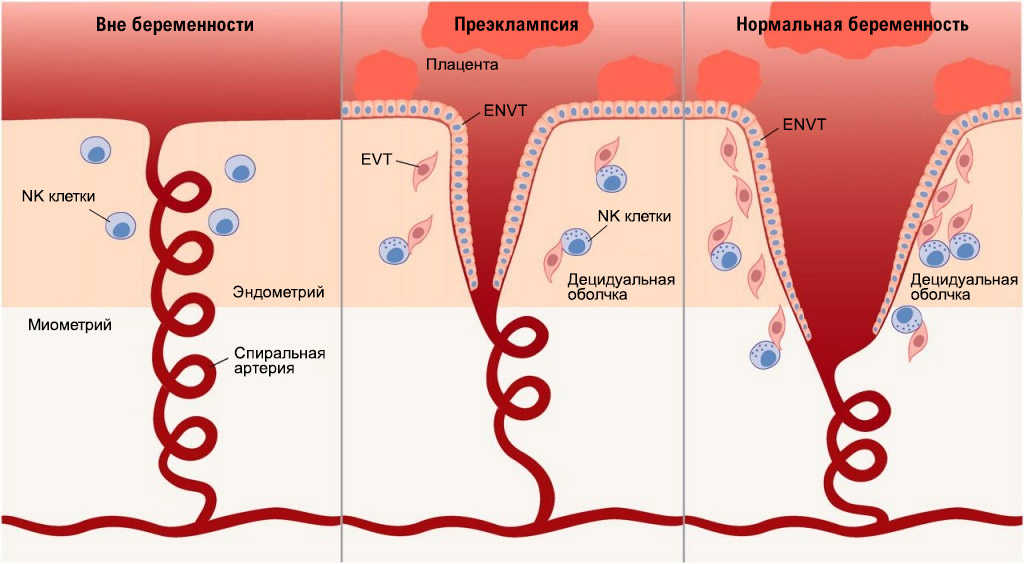
Нарушения плацентации
В том случае, если ремоделирование спиральных артерий происходит не в полной мере, артерии сохраняют свою способность к сокращению, что на поздних сроках беременности может приводить к снижению кровоснабжения плода – плацентарной недостаточности и, как следствие, внутриутробной задержке роста плода.
При этом плод из-за снижения поступления к нему кислорода подаёт определённые сигналы материнскому организму, в ответ на которые организм женщины реагирует повышением артериального давления. При повышении артериального давления кровоснабжение плода в норме должно усиливаться, чего не происходит в том случае, если спиральные артерии матки в первом и начале второго триместров беременности не потеряли своей способности к сокращению.
Таким образом в том случае, если процессы ремоделирования спиральных артерий произошли правильно в сроке до шестнадцати недель беременности, риски развития таких осложнений беременности, как внутриутробная задержка роста плода и преэклампсия минимальны. Если же процессы формирования плаценты были нарушены это с высокой долей вероятности приведёт к данным осложнениям гестации.
Симптомы преэклампсии
Преэкламсия бывает двух степеней – умеренная и тяжёлая. В зависимости от степени тяжести заболевания могут возникать различные симптомы:
- Повышение АД выше 140/90 мм рт. ст.;
- Протеинурия (наличие белка > 0,3 г в суточной моче);
- Отёки;
- Головная боль;
- Нарушение зрения;
- Тошнота, рвота;
- Боли в эпигастрии, правом подреберье;
- Олигурия (уменьшение отделения мочи менее 500 мл в сутки);
- Заложенность носа;
- Сухой кашель.
Осложнения преэклампсии для матери
Преэклампсия является четвёртой по частоте причиной материнской смертности.
Высокий уровень артериального давления (>160/110 мм рт. ст.) значительно повышает риски развития геморрагического инсульта. Тяжёлая преэклампсия может сопровождаться полиорганной недостаточностью, отёком головного мозга, массивным кровотечением, угрожая жизни матери.
Отдалённые последствия для здоровья матери также существуют. Перенесённая женщиной преэклампсия повышает риски сердечно-сосудистых (инсультов, инфарктов) осложнений, заболеваний почек (хроническая почечная недостаточность), органа зрения (патология сетчатки), метаболических нарушений (сахарный диабет 2 типа) в течение жизни. Учитывая тот факт, что преэклампсия является жизнеугрожающим состоянием для матери, а терапия во время беременности оказывается неэффективной, врачам к сожалению приходится прибегать к оперативному родоразрешению путем операции кесарева сечения даже тогда, когда прогноз для плода крайне неблагоприятный (в сроке менее 25-26 недель беременности).
Осложнения преэклампсии для плода
Преэклампсия является одной из основных причин перинатальной заболеваемости и смертности.
Основной причиной гибели плода во время беременности (антенатальной гибели плода) в случае развившейся преэклампсии является декомпенсация плацентарной недостаточности, то есть глубокое нарушение функции плаценты, приводящее к тяжёлой гипоксии плода.
Значимой причиной гибели и заболеваемости новорожденных является глубокая недоношенность. Дети, родившиеся в сроке 22-25 недель имеют крайне неблагоприятный прогноз, на данном сроке выживаемость новорожденных минимальна. С увеличением срока беременности смертность и заболеваемость новорожденных снижается и в большой степени зависит от возможностей медицинского учреждения к оказанию помощи недоношенным детям, как в ближайшие часы и дни после родов в отделении реанимации новорожденных, так и на втором этапе выхаживания – в отделении патологии новорожденных.
Преждевременые роды – это роды в сроке от 22 недель до 36 недель 6 дней.
Новорожденные, рожденные до срока 37 недель считаются недоношенными.
Среди последствий недоношенности можно выделить:
- Заболевания органа зрения (ретинопатия недоношенных);
- Нарушения слуха (тугоухость);
- Бронхолёгочная дисплазия (патология лёгких);
- Патология нервной системы (ДЦП);
- Задержка психомоторного развития.
Таким образом, крайне важным является выявление женщин из групп риска развития преэклампсии на этапе предгравидарной подготовки (подготовки к беременности) и на ранних сроках беременности (до 12 недель).
Профилактика преэклампсии
В настоящий момент существует единственный эффективный метод профилактики преэклампсии – приём аспирина (ацетилсалициловой кислота) в дозе 75-162 мг, начатый в сроке до 16 недель беременности. Но чем раньше женщина начнёт приём препарата, тем ниже вероятность возникновения осложнений, связанных с нарушением плацентарной функции.
Можно выделить категории женщин, приём аспирина которым показан с этапа предгравидарной подготовки или сразу при наступлении беременности.
Аспирин показан женщинам с высоким риском преэклампсии:
- преэклампсия во время предыдущей беременности;
- хронические заболевания почек;
- аутоиммунные заболевания (системная красная волчанка, антифосфолипидный синдром и другие);
- сахарный диабет 1 или 2 типа;
- хроническая артериальная гипертензия;
- ожирение 2 и более степеней (ИМТ > 35 кг/м2);
- преэклампсия у родственниц по женской линии (мама, бабушка, сёстры);
- многоплодная беременность;
- Лейденcкая мутация (F5);
- возраст старше 35 лет;
- заболевания соединительной ткани;
- продолжительность половой жизни до беременности менее 6 месяцев.
Оценка риска преэклампсии
Группу женщин с высоким риском развития преэклампсии также можно определить в первом триместре на этапе проведения первого пренатального скрининга в сроке 11 недель – 13 недель 6 дней.
Риски преэклампсии высчитываются на основании:
- Данных анамнеза (ПЭ в прошлом, семейный анамнез, возраст, наличие хронических заболеваний и другое);
- Среднего артериального давления;
- Пульсационного индекса маточных артерий (ПИ МА);
- Определение концентрации плацентарного фактора роста в крови (PlGF) и ассоциированного с беременностью протеина А (PAPP-A).
Для высокого риска преэклампсии характерны:
- высокие значения среднего артериального давления;
- высокие значения пульсационного индекса маточных артерий;
- низкие показатели плацентарного фактора роста (PlGF).
Следует отметить, что до сих пор во многих медицинских учреждениях во время проведения скрининга первого триместра при ультразвуковом исследовании не проводится оценка пульсационного индекса маточных артерий, а биохимический скрининг включает в себя оценку только двух маркёров – ассоциированного с беременностью протеина А (PAPP-A) и свободной субъединицы бета-ХГЧ (св. бета-ХГЧ), что не позволяет с высокой точностью выявить группу беременных с высоким риском плацентарных нарушений!
Дополнительным, но менее чувствительным маркёром, чем плацентарный фактор рост является ассоциированный с беременностью протеин А (PAPP-A). Снижение PAPP-A, особенно в сочетании со снижением PlGF, характерно для беременных с высоким риском развития преэклампсии.
Дополнительно оценивать уровень этих маркёров можно оценивать и на более раннем сроке беременности. Оценка уровня ассоциированного с беременностью протеина А (PAPP-A) возможна уже с 8 недель гестации, а плацентарного фактора роста (PlGF) – с 10 недель.
Эти анализы можно сдать в лаборатории ЦИР.
Огромное значение в ведении беременных с высоким риском плацентарных нарушений отводится оценке фето-плацентарного и маточно-плацентарного кровотоков при помощи допплерометрии. В сроке, начиная с 16-17 недель гестации в случае высокого риска ранней преэклампсии, и в сроке 19-21 недели у всех беременных женщин обязательным является оценка пульсационного индекс маточных артерий и артерий пуповины плода. Нормы значений отличаются в различные сроки беременности и оцениваются при помощи специальных таблиц врачами ультразвуковой диагностики. Интервалы и частота исследований индивидуальны в каждом случае.
Допплерометрия маточно-плацентарного и плодово-плацентарного кровотоков в сочетании с фетометрией при ультразвуковых исследованиях позволяют своевременно выявлять беременных с тенденцией к внутриутробной задержке роста плода (или синдрому задержки роста плода).
Для оценки риска развития преэклампсии в сроке более 20 недель возможно определять соотношение растворимой fms-подобной тирозинкиназы-1 к плацентарному фактору роста (sFlt-1/PlGF). Растворимая fms-подобная тирозинкиназа-1 (s1Flt) – это белок, вырабатываемый плацентой.
При нормально протекающей беременности уровень растворимой fms-подобной тирозинкиназы-1 остается стабильно низким вплоть до 33 – 36 недель беременности, после чего может повышаться. Уровень плацентарного фактора роста при благополучно протекающей беременности наоборот высокий. Соотношение растворимой fms-подобной тирозинкиназы-1 к плацентарному фактору роста (sFlt-1/PlGF) при этом низкое.
Напротив, при преэклампсии уровень растворимой fms-подобной тирозинкиназы-1 повышен, а значение плацентарного фактора роста низкое, соотношение sFlt-1/PlGF выше, чем при нормально протекающей беременности. Соотношение растворимой fms-подобной тирозинкиназы-1 к плацентарному фактору роста менее 38 исключает развитие преэклампсии в течение ближайших 7 дней. Увеличение соотношения более 85 в сроке менее 34 недель гестации и более 110 в сроке более 34 недель ассоциировано с высоким риском развития преэклампсии.
Лечение преэклампсии
Эффективного медикаментозного лечения преэклампсии в настоящий момент не существует. Лечение преэклампсии на амбулаторном (поликлиническом) этапе симптоматическое и возможно только в случае умеренной преэклампсии.
Терапия включает в себя:
- Диету с ограничением соли (< 4 грамм в сутки);
- Антигипертензивную терапию.
Лечение тяжёлой преэклампсии возможно только в стационаре и, как правило, включает в себя:
- Поликомпонентную антигипертензивную терапию (2-3 антигипертензивных препарата);
- Противосудорожную терапию;
- Магнезиальную терапию;
- Профилактику респираторного дистресс-синдрома плода (РДС) в сроке менее 34 недель гестации.
Медикаментозная терапия в случае тяжёлой преэклампсии обычно длится не более 48 часов и направлена на:
- Стабилизацию состояния матери;
- Проведение профилактики респираторного дистресс-синдрома плода и новорожденных (РДС).
Единственным эффективным методом лечения тяжёлой преэклампсии до сих пор является родоразрешение.
Планирование повторной беременности после перенесенной преэклампсии
Рекомендуемый интервал между родами и наступлением следующей беременности составляет 2 года, однако этот срок может быть сокращён до 6 – 12 месяцев в отдельных случаях.
На этапе подготовки к следующей беременности женщине с тяжёлыми осложнениями беременности в анамнезе (перенесённой преэклампсией, внутриутробной задержкой роста плода, антенатальной гибелью плода) рекомендуется более углублённое обследование для оценки факторов риска развития данных состояний.
В первую очередь женщина должна посетить врачей следующих специальностей для того, чтобы исключить последствия перенесённой преэклампсии и скомпенсировать имеющиеся заболевания:
-
Терапевт.
Врач-терапевт исключит хроническую артериальную гипертензию, при необходимости рекомендует суточное мониторирование артериального давления (СМАД). При подтверждении диагноза терапевт рекомендует антигипертензивную терапию с учётом подготовки к следующей беременности. -
Невролог.
Врач-невролог исключит неврологическую патологию, как следствие перенесённой преэклампсии. -
Нефролог.
Врач-нефролог исключит почечную патологию, являющуюся фактором риска возникновения преэклампсии. -
Эндокринолог.
Врач-эндокринолог рекомендован женщинам с лишним весом и ожирением, а также с целью исключения нарушения толерантности к глюкозе и сахарного диабета. -
Офтальмолог.
Врач-офтальмолог исключит патологию органа зрения, в первую очередь сетчатки, которое зачастую являются следствием перенесённой преэклампсии. -
Акушер-гинеколог.
Врач акушер-гинеколог рекомендует план обследования на этапе подготовки к беременности.
План обследования определяется индивидуально в каждом случае, но, как правило, включает в себя:
- Полиморфизмы генов гемостаза – 19 факторов.
Среди полиморфизмов генов гемостаза ключевую роль в развитии плацентарных нарушений могут играть факторы коагуляции (Лейденская мутация, фактор протромбина, 11 фактор коагуляции), факторы, ответственные за процессы фибринолиза (PAI-11, F13A1, PAI-1, фактор Хагемана), а также факторы тромбоцитарных рецепторов (ITGA2, ITGB3, GP1ba, P2RY12). - Полиморфизмы генов сосудистого тонуса и преэклампсии.
Полиморфизмы генов преэклампсии – это набор генов, ответственных за поддержание водно-солевого и электролитного составов крови, а также артериального давления. Сочетание различных генов из данной панели может являться фактором риска развития преэклампсии. - Полиморфизмы генов цитокинов.
Одним из наиболее значимых генов, при выявлении полиморфизма по которому сочетается с риском развития преэклампсии является фактор некроза опухоли альфа. - Блок аутоантител, волчаночный антикоагулянт, иммуноблот на антинуклеарные факторы, антинуклеарный фактор, ревматоидный фактор, ультрачувствительный С-реактивный белок.
Данное обследование рекомендуется с целью исключения аутоиммунных факторов риска, значимо отягощающих течение беременности и повышающих риски развития преэклампсии. - Типирование обоих супругов по генам HLA 1 и 2 классов.
Типирование по генам HLA 1 класса позволяет оценить не только конфигурацию С1/С2 супружеской пары. Определение гаплотипов каждого из супругов делает возможным определить их связь с теми или иными патологиями, существенно влияющими на репродуктивное здоровье. - Гликированный гемоглобин, глюкоза сыворотки натощак, метаболический блок.
Рекомендуются для исключения нарушения толерантности к глюкозе, особенно у женщин с лишним весом. - Иммунограмма.
Позволяет оценить иммунную конституцию человека, тенденцию к ответу иммунной системы по гуморальному или клеточному звену. Так, гуморальный тип ответа зачастую связан с аутоиммунной патологией.
Указанное выше обследование позволяет врач акушеру-гинекологу оценить наличие тех или иных факторов риска развития преэклампсии и рекомендовать соответствующую терапию на предгравидарном этапе и на самых ранних сроках беременности.
Так, если у женщины выявлены аутоиммунные факторы риска развития преэклампсии - антитела к ДНК или фосфолипидам, положительный волчаночный антикоагулянт, по результатам иммунограммы иммунорегуляторный индекс (ИРИ) имеет тенденцию к увеличению, обнаружены вариантные гены противовоспалительных цитокинов (интерлейкина-4), а также определён гаплотип HLA, ассоциированный с высоким риском развития аутоиммунной патологии, врач акушер-гинеколог будет рассматривать вопрос о добавлении в медикаментозную терапию таких препаратов, как нормальный иммуноглобулин человеческий, гидроксихлорохин.
При выявлении определенных комбинаций генов гемостаза и сосудистого тонуса будет рассмотрен вопрос о добавлении в терапию антикоагулянтов (низкомолекулярного или нефракционированного гепарина).
Поэтому без полного обследования нельзя однозначно сказать, достаточно ли будет приёма низкодозированного аспирина во время беременности или нет. Каждый случай рассматривается индивидуально.
Супружеская пара, жене 33 года, мужу 35 лет.
В 2015 году – экстренное кесарево сечение в сроке 27 недель в связи с тяжёлой преэклампсией, в 2018 году – экстренное кесарево сечение в сроке 24 недель в связи с тяжёлой преэклампсией.
Первая беременность протекала без особенностей со слов пациентки до 26 недель, в дальнейшем – повышение АД до 190/110 мм рт. ст., сопровождающееся головной болью, дезориентацией, нарушением координации. По данным УЗИ в сроке 27 недель тяжёлая плацентарная недостаточность (нулевой кровоток в артерии пуповины, снижение кровотока в средней мозговой артерии), внутриутробная задержка роста плода 3 степени. В результате оперативного родоразрешения родился мальчик весом 530 грамм и умер на 3 сутки.
Вторая беременность протекала без особенностей до срока 24 недель. На ранних сроках гестации беременная была консультирована гематологом, была рекомендована терапия низкомолекулярными гепаринами (клексан). В сроке 24 недель – тяжелая плацентарная недостаточность, тяжёлая задержка роста плода, тяжелая преэклампсия. Ситуация осложнилась частичной отслойкой нормально расположенной плаценты, в результате развилось массивное кровотечение, с целью остановки которого была выполнена перевязка маточных артерий.
По результатам проведенного обследования:
- Функция щитовидной железы в норме.
- По данным обследования на полиморфизмы генов гемостаза выявлена гетерозиготная мутация гена протромбина (второго фактора свертывающей системы крови).
- При исследовании крови на наличие аутоантител антител к ДНК, к компонентам щитовидной железы, а также к фосфолипидам не выявлено – аутоиммунный компонент отсутствует.






Комментарии
Дальше, ультразвуковой показатель, который касается маточного кровотока (пульсационный индекс маточных артерий) и артериальное давление - это базовые показатели, которые входят в расчет рисков преэклампсии у нас при беременности.
Результат 1: 44 указывает на то, что у вас были отклонения по этим показателям. А это значит, что у вас идут скрытые риски. Поэтому здесь важен регулярный контроль гемостаза во время беременности и дополнительный контроль допплеромерией. Обычно мы рекомендуем её проводить с 16-й недели беременности раз в несколько недель: в 20 недель, в 24 недели, в 29 недель…
После 19 недель беременности здесь важно отслеживать соотношение sFlt-1/PLGF – это очень важный маркер.
После 30 недель беременности мы советуем дополнительно смотреть фактор фон Виллебранда, потому что он имеет тенденцию резкого повышения, что увеличивает риски.
Обязательно после 30 недель беременности регулярная КТГ для отслеживания состояния ребенка.
Контроль показателей общего анализа мочи, для того чтобы исключать протеинурию.
Ежедневный контроль артериального давления.
И обязательно промежуточное ультразвуковое исследование после 30 недель беременности.
Даже если всё будет идти идеально, после 30 недель беременности должен быть очень жесткий скрининг. И всё зависит от того, как вас вели на предыдущем этапе. Но так как у вас было 1:44 - контроль за рисками нарушения плацентарной функции должен быть обязательно.
Сейчас беременная может ли повторится преэклампсия?
План обследования лучше определить на консультации, в зависимости от Вашего анамнеза и уже проведенных исследований. Обязательно нужно исследовать: полиморфизмы генов гемостаза и сосудистого тонуса, блок аутоантител, волчаночный антикоагулянт, иммуноблот на антинуклеарные факторы, HLA типирование 1 и 2 класса (обоим супругам).
С уважением, врач акушер-гинеколог Панасенко Светлана Гурьевна.
1. В рамках подготовки в след. Беременности какие анализы лучше сдать?
2. На какие показатели ориентироваться, если по биохимическому анализу крови был риск развития ПЭ до 34н.б. 1:4053, а PAPp-A 2,480 МЕ/л?
План обследования лучше определить на консультации, в зависимости от Вашего анамнеза и уже проведенных исследований. Обязательно нужно исследовать: полиморфизмы генов гемостаза и сосудистого тонуса, блок аутоантител, волчаночный антикоагулянт, иммуноблот на антинуклеарные факторы, HLA типирование 1 и 2 класса (обоим супругам).
По результатам скрининга 1 триместра следует ориентироваться на значения, переведенные в МоМ. (Вы написали в МЕ/мл).
С уважением,
Подскажите пожалуйста, насколько этот показатель является высоким риском? Преэклампсия неизбежна или возможно, что она не наступит?
Однако, это не говорит о том, что преэклампсия обязательно разовьётся, только о более высоком риске.
Во-первых, надо обязательно смотреть, чем он обусловлен.
Во-вторых, применять профилактику (аспирин).
В-третьих, вести беременность с акцентом на плацентарную функцию (концепция Плацента клиник), проводя тщательный мониторинг состояния плода и плаценты.
Более подробно разобраться с ситуацией можно на консультации у специалистов ЦИР.
Исследования показывают, что риск повторного возникновения преэклампсии составляет в среднем 20%, однако эксперты называют диапазон от 5% до 80% в зависимости от того, когда у вас была преэклампсия во время предыдущей беременности, насколько она была тяжелой и какие дополнительные факторы риска у вас могут быть.
Важно учитывать, что помимо таких состояний как повышение давления, наличие белка в моче могут быть такие осложнения, как преждевременная отслойка нормально расположенной плаценты, задержка внутриутробного развития плода, антенатальная гибель плода), а также повышение риска сердечно-сосудистых заболеваний вне беременности.
Поэтому мы рекомендуем обследование для выявления факторов риска. Наметить план, сдать анализы и получить консультацию можно у специалистов нашего Центра иммунологии и репродукции.
В первую беременность приэклампсия и экс 32 недели, прошло 1,5 года беременность снова сейчас, как мне обезопасить себя от риска приэклампсии какие анализы можно сдать, т.к очень страшно переживать такое еще раз.
Буду рада Вам помочь минимизировать Ваши риски, переживания и страхи.
С уважением Евграфова Александра Владимировна, акушер-гинеколог ЦИР.
Благодарю за очень информативную статью!
Не могли бы вы прояснить, почему «продолжительность половой жизни до беременности менее 6 месяцев» — является риском для Преэклампсии? Никогда не слышала и не видела данных на этот счет.
Заранее благодарю за ответ!
Здесь имеется в виду категория беременных-подростков, совсем недавно начавших половую жизнь.
По данным разных авторов беременные младше 20 лет чаще дают развитие преэклампсии, чем женщины старше 20 лет.
Это связано с несколькими причинами: биологическими факторами и социальными.
К биологическим относят незрелость организма будущей мамы (сердечно-сосудистой, эндокринной систем). А к социальным причинам - недообследованность, наличие вредных привычек, недостаточная материальная обеспеченность, иногда нежелание сотрудничать с медицинскими работниками и др.
Среднее артериальное давление 71,66 мм рт. Ст эквивалентно 0,766 мом
PIGF - 23,80pg/ml, эквивалентно - 0,847 МОМ). ПИ слева: 1,830, ПИ справа: 1,740)
На данный момент я на 32 неделе беременности, белка пока нет в моче, самочувствие удовлетворительное. КТГ 8 баллов. Гемоглобин 97. С 20 недели беременности назначили мне аспирин в дозе 100 мг. Я сейчас очень переживаю, что с ребенком что-то не так будет, или же буду какие-то проблемы. Помогите, пожалуйста, разобраться в ситуации. У меня и правда есть высокие риски? Заранее спасибо! Буду ждать вашего ответа. ????????
Подскажите, какие обследования/анализы/восстановительную терапию необходимо провести после родов с преэклампсией?
(Почки/печень/сосуды/сердце….)
На данный момент терапия допегит+амплодипин+клексан