 Материал подготовлен урологом-андрологом ЦИР Живулько А.Р.
Материал подготовлен урологом-андрологом ЦИР Живулько А.Р.
Одной из многообещающих и быстро развивающихся отраслей современной биологии и медицины являются клеточные технологии. В рамках этой отрасли существует множество перспективных направлений, представляющих интерес с позиции их прикладного применения в решении насущных медицинских проблем сегодняшнего дня, в том числе и бесплодия.
В основе идеи преодоления бесплодия с помощью клеточных технологий лежит способность стволовых клеток при определенных условиях дифференцироваться в специализированные клетки, способные к мейозу с образованием гаплоидных половых клеток.
У млекопитающих процесс развития половых клеток начинается с 4 недели эмбриогенеза, когда в первичную гонаду начинают активно мигрировать первичные половые клетки – гоноциты. В дальнейшем эти клетки предшественники вовлекаются в процесс пролиферации и дифференцировки с образованием сперматогоний (овогоний) и сперматоцитов (овоцитов), которые вступают в мейотическое деление с образованием в конечном счете гаплоидных половых клеток.
Под воздействием цитокинов, продуцируемых экстраэмбриональными тканями, мышиные и человеческие эмбриональные стволовые клетки и индуцированные плюрипотентные клетки могут дифференцироваться в эпибластоподобные клетки, которые, в свою очередь, могут дифференцироваться в гоноцитоподобные клетки в условиях in vitro(3,8). Для получения гаплоидных половых клеток, которые можно было бы использовать в ЭКО, гоноцитоподобная клетка должна подвергнуться мейозу in vitro.
Однако именно воссоздание процесса мейоза в условиях in vitro оставалось главным препятствием на пути получения функциональных гамет in vitro. В прошлом уже были достигнуты значительные успехи в направлении получения женских половых клеток – ооцитов: еще в 2003 году Hübner и коллегами были получены мышиные ооциты из эмбриональных стволовых клеток(1), а в 2012 году Hayashi и коллегам удалось получить здоровые особи, используя мышиные яйцеклетки, выращенные из эмбриональных стволовых клеток(2).
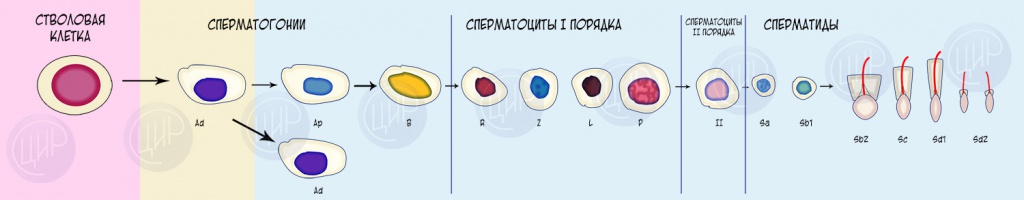
Рисунок врача лаборатории ЦИР Бабкеевой Э.Р.
До недавнего времени значительно меньше внимания уделялось разработке методики получения мужских половых клеток in vitro. В 2011 году уже упомянутым коллективом исследователей из Университета Киото полученные in vitro гоноцитоподобные клетки были пересажены в тестикулы мыши, из которых впоследствии развивались сперматозоиды(3). Однако риск онкогенеза препятствует использованию такого подхода в экспериментах с людьми. Таким образом, способность человеческих гоноцитоподобных клеток образовывать сперматозоиды остается неизвестной.
Geijsen и коллегами были получены мышиные гаплоидные мужские половые клетки в условиях in vitro, которые при интрацитоплазматическом введении в ооцит приводили к развитию бластоцисты(4). Испанские специалисты сообщают о получении гаметоподобных гаплоидных клеток уже из человеческих эмбриональных стволовых клеток и индуцированных плюрипотентных клеток(5). Также Easley и коллегам удалось получить сперматидоподобные клетки из человеческих стволовых плюрипотентых клеток(9). Но не в одном из этих исследований полученные гаметоподобные половые клетки не были с успехом использованы для получения здоровых организмов, которые впоследствии могли бы давать здоровое потомство.
25 февраля 2016 в журнале Cell была опубликована статья «Complete Meiosis from Embryonic Stem Cell-Derived Germ Cells In Vitro», в которой коллективом специалистов Государственной Лаборатории Репродуктивной медицины, Департамента Гистологии и Эмбриологии Медицинского Университета г. Нанкин (Китай) сообщается об успешном получении мышиной сперматидоподобной клетки из гоноцитоподобной клетки в условиях in vitro, а также успешного дальнейшего использования полученной сперматидоподобной клетки в процедуре ИКСИ, в результате которой родились здоровые особи, которые впоследствии производили здоровое потомство(6).
Инициация мейоза в условия in vitro была осуществлена путем совместного культивирования гоноцитоподобных клеток и ранних постнатальных тестикулярных клеток KITW/KITW-V мыши с добавлением активина А, ретиноевой кислоты и костных морфогенетических белков ВМР 2,4 и 7. Для гормональной стимуляции формирования гаплоидной сперматидоподобной клетки на седьмые сутки морфогены: активин А, ретиноевая кислота и костные морфогенетические белки ВМР 2,4 и 7 удалялись из среды, после чего в культуру добавляли фолликулостимулирующий гормон, экстракт бычьего гипофиза и тестостерон. Первые сперматидоподобные клетки образовывались на десятый день культивирования. На четырнадцатый день культивирования клеточная культура на 14-20% состояла из сперматидоподобных клеток.
Для оценки целостности генома из полученных сперматидоподобных клеток были отобраны 8 клеток. Из них 6 были гаплоидными, одна имела хромосомные делеции и одна была диплоидной.
Оценка функциональных возможностей полученных сперматидоподобных клеток была произведена с помощью интрацитоплазматической инъекции этих клеток в ооциты. 379 ооцитов было подвергнуто введению сперматидоподобных клеток, в результате чего было получено 317 двухклеточных эмбрионов. Имплантация этих эмбрионов привела к рождению 9 здоровых особей, достигших репродуктивного возраста и давших здоровое потомство.
Таким образом, в данном исследовании авторы впервые продемонстрировали методику культивирования сперматидоподобных клеток in vitro, доказали их функциональность с помощью процедуры ИКСИ. Ими впервые полностью представлен путь от эмбриональной стволовой клетки до здоровой особи способной к воспроизводству потомства. Также необходимо отметить, что исследование отвечает золотому стандарту, предложенному для культивирования половых клеток in vitro(7).
Данная работа является значительным достижением в области клеточных технологий, о чем заявляют не только авторы работы, но и ведущие специалисты этой области во всем мире. Исследование создало предпосылки для возможного применения такого подхода для лечения мужского бесплодия в будущем.
На пути к клиническому внедрению метода существует множество преград. В исследовании были использованы эмбриональные стволовые клетки, которые отсутствуют в зрелом организме, методика же должна быть воспроизводима с использованием индуцированных плюрипотентных клеток, которые возможно добыть у взрослого человека. Помимо этого, развитию технологии будут препятствовать серьезные вопросы юридического и этического характера.
В случае если все препятствия будут преодолены и будет разработана технология выращивания функциональных человеческих гамет в условиях in vitro, такая методика может стать вариантом выбора для бесплодных мужчин с необструктивной азооспермией тестикулярного генеза, у которых невозможно добыть сперматозоиды и продолговатые сперматиды (мужчин перенесших в детском возрасте химиотерапию, с Y-хромосомными полными делециями AZFa, b, тестикулярной атрофии вследствие травмы, нарушения васкуляризации, идиопатических форм и др.) – ситуации, в которых единственным выбором сегодня остается использование спермы донора.