Уважаемые пациенты! С 27 апреля клиника ЦИР на Новокузнецкой НЕ РАБОТАЕТ. Подробнее...
График. Онлайн-консультации. Оплата анализов онлайн. Анализы в другом городе.
Кафедра урологии МГМСУ (г.Москва)
НЦ акушерства, гинекологии и перинатологии РАМН (г.Москва)
Результаты анализов 3660 образцов эякулята, комплексное клинико-лабораторное обследование 1066 мужчин из бесплодных пар и 37 фертильных позволяют сделать вывод, что наличие аутоиммунных реакций против сперматозоидов всегда приводит к снижению вероятности наступления беременности. Нарушения качества спермы и реальной фертильности нарастают с увеличением доли прогрессивно-подвижных сперматозоидов, покрытых антиспермальными антителами (АСАТ). Доля первичных нарушений и продолжительность бесплодия по сравнению с фертильными мужчинами статистически достоверны при любых значениях MAR%IgG>0%. По сравнению с бесплодными без АСАТ, при нормозооспермии вероятность наступления беременности у АСАТ-позитивных мужчин существенно снижена при MAR% IgG>50%. Частота наступления беременности в естественном цикле без лечения от мужчин с MAR%IgG>50% составляет менее 2%, а при MAR%IgG=100% практически равна 0. Выявлена негативная корреляция между долей всех живых сперматозоидов, покрытых АСАТ классов IgG, IgA, IgM и количественными показателями спермограммы, но не с продолжительностью бесплодия. Лечение бесплодных мужчин с аутоиммунными реакциями против сперматозоидов требует использования специальных методов лечения (корикостероиды, протеолитические ферменты) независимо от величины MAR%IgG>0%. Неспецифическая стимуляция сперматогенеза у мужчин с АСАТ не приводит к улучшению количественных показателей спермограммы за счет усиления аутоиммунного процесса.
Известно [1-3 и др.], что развитие аутоиммунных реакций против сперматозоидов обычно приводит к бесплодию. Признаком таких реакций служит присутствие в сперме антиспермальных антител (АСАТ), а стандартными измеряемыми показателями - доля сперматозоидов, покрытых АСАТ [4-6]. Однако АСАТ могут встречаться и у мужчин с подтвержденной фертильностью [7-9], поэтому до сих пор не ясно, какое количество АСАТ является нормальным, а какое - патологическим, приводящим к нарушению репродуктивной функции. За последние 20 лет эксперты ВОЗ трижды меняли границу нормы. Согласно первой редакции «Руководства ВОЗ по лабораторному исследованию спермы человека и взаимодействия спермы с цервикальной слизью» (1980) диагноз «иммунологическая причина (первопричина) мужского бесплодия» нужно было ставить, когда не менее 40% подвижных сперматозоидов были покрыты АСАТ. Вторая и третья редакция Руководства (1987,1992) рекомендовали ставить такой диагноз при более чем 10% АСАТ-позитивных сперматозоидах, последняя четвертая (1999) - когда таких сперматозоидов не менее половины. В то же время, как отмечают сами эксперты [10], некоторые клиники вообще не учитывают этот фактор, не считая его клинически значимым, другие по-прежнему опираются на непрямые тесты агглютинации и иммобилизации, во многих центрах предлагают свои диагностические критерии «иммунологического бесплодия», противоречащие друг другу.
Объективными препятствиями для установления границ нормы для эякулята, в т.ч. присутствия АСАТ, являются несколько факторов. Во-первых, большая индивидуальная и популяционная изменчивость показателей спермограммы у бесплодных и фертильных мужчин, в результате чего распределение переменных не имеет отчетливых разрывов или двух различных пиков, из которых один соответствовал бы «норме», другой - «патологии» [11]. Во-вторых, систематические ошибки, связанные с субъективной оценкой количества АСАТ-позитивных сперматозоидов исследователем при микроскопии в случае применения рекомендованных ВОЗ MAR- и IBT-тестов [5]. В-третьих, влияние на вероятность наступления беременности дополнительных (случайных) факторов, в частности патологии репродуктивных органов у супруги или наличие у нее фертильных сексуальных партнеров вне брака. В результате, диагноз, прогноз и ожидаемые результаты лечения для конкретного больного не могут быть определены однозначно, а могут быть выражены только через вероятность.
С целью получить собственные данные, характеризующие зависимость между количеством АСАТ у мужчин и вероятностью нарушения репродуктивной функции супружеской пары выполнено настоящее исследование.
Для подтверждения роли аутологичных АСАТ как фактора бесплодия использованы три стандартных критерия, рекомендованные для оценки состояния как патологического [12]: 1) необычность состояния с точки зрения статистики; 2) проявление состояния в виде болезни, т.е. связь состояния с нарушением функции; 3) возможность улучшения состояния при лечении.
Был проведен анализ образцов эякулята 3660 мужчин, обследованных по поводу бесплодия, воспалительных заболеваний репродуктивного тракта и профилактически. Комплексный анализ эякулята выполняли в соответствии с критериями ВОЗ (1992).
Были проанализированы данные комплексного клинико-лабораторного обследования 480 бесплодных мужчин с диагностированными АСАТ. Группу сравнения составили 36 фертильных и 550 бесплодных мужчин без АСАТ. Методом MAR [13] определяли долю подвижных сперматозоидов, покрытых антителами IgG и IgA, методом ИФА (ELISA) - концентрацию АСАТ в сыворотке крови [14], методом проточной цитофлуорометрии (ПЦМ) - процент спермиев, покрытых антителами классов IgG, IgA, IgM, количество антител на один сперматозоид, а так же спонтанную и индуцированную ионофором А23187 акросомальную реакцию [15]. Выполняли исследования гонадотропинов ЛГ, ФСГ, ПРЛ, тестостерона (Т), эстрадиола (Е2) и секс-гормон-свяхывающего глобулина (СГСГ). Учитывалось наличие скрытых инфекций репродуктивного тракта (ИРТ); диагностику ИРТ осуществляли по наличию специфической ДНК методами ДНК-зондов и ПЦР [16], для условно-патогенных микроорганизмов - посевом на питательные среды. Мужчины с острым течением воспалительного процесса (уретрит, орхит, эпидидимит, простатит) были исключены из исследования.
Женщины из бесплодных пар находились под наблюдением гинекологов и при необходимости получали соответствующую терапию.
Полученные данные обрабатывали методами вариационной статистики при помощи t критерия Стьюдента и F критерия Фишера для независимых и парных значений и ХИ-квадрат, вычисляли коэффициент корреляции r Пирсона.
Показано, что АСАТ в сперме присутствуют у 18% обследованных мужчин, в т.ч. MAR%IgG<10% - примерно у 3% мужчин, MAR% от 10 до 49% - у 7%, MAR% от 50 до 99% - у 4% и все подвижные сперматозоиды были покрыты АСАТ у 4% обследованных.
Частота обнаружения АСАТ зависела от использованных методов. Наиболее чувствительным оказалось прямое определение антител на сперматозоидах - MAR-тест. Совпадение положительных результатов ИФА с результатами MAR%IgG>0 (т.н. чувствительность) наблюдалась в 6% случаев (2 из 32).
Имелись различия в частоте обнаружения АСАТ у мужчин, обследуемых по различным показаниям: с профилактической целью, в случаях бесплодного брака, привычного невынашивания, хроническом неспецифическом простатате, или скрининговом обследовании по поводу наступившей беременности. Наиболее высокий процент выявления АСАТ наблюдался в группе бесплодных пациентов, наименьший - при хроническом неспецифическом простатите (табл.1).
| Показатели> | Фертильные (n=36) | Бесплодные (n=1374) | Неспециф. простатит (n=155) |
|---|---|---|---|
| Иммунологический фактор (абс. число/проценты) | 8 (22,2%) | 660 (48,0%) | 8 (5,2%) |
| Средние значения MAR у пациентов с АСАТ (%) | 24,8.10,8 | 44,8.1,5 | 19,0.11,7 |
| Min и Max значения MAR у пациентов с АСАТ (%) | 1 – 60% | 2 – 100% | 1 – 100% |
| Знач. MAR меньше 10% (абс. число/проценты) | 3 (8,3%) | 132 (9,6%) | 5 (3,2%) |
| Знач. MAR10-49% (абс. число/проценты) | 3 (8,3%) | 268 (19,5%) | 2 (1,3%) |
| Знач. MAR не менее 50% (абс. число/проценты) | 2 (5,5%) | 260 (18,9%) | 1 (0,6%) |
Таблица 1. Частота выявления АСАТ методом MAR у мужчин репродуктивного возраста
В группе фертильных мужчин, жены которых забеременели без лечения в естественном цикле, АСАТ присутствовали в 22% случаев (8/36), в т.ч. MAR%IgG от 10 до 49% - у 3 человек (8%) и больше 50% - у 2 чел (5%). Максимальное значение MAR%IgG при этом составляло 60%, IgA - 10%. Зарегистрированные случаи беременности в естественном цикле без лечения (более чем 400 находящихся под наблюдением пар с АСАТ у мужчин) составляют ожидаемую вероятность зачатия: 4,2% при MAR%IgG<10%, 1,7% при MAR%IgG 10 до 99% и 0% при MAR%IgG =100%.
Анализ данных анамнеза показал (рис.1), что у всех мужчин из бесплодных пар средняя продолжительность половой жизни в браке без применения контрацепции и доля первичного нарушения репродуктивной функции существенно больше, чем у фертильных (P<0,001). У бесплодных мужчин с АСАТ по сравнению с бесплодными без АСАТ различия в доле первичных нарушений становятся статистически значимыми для MAR%IgG>80% (P<0,01-0,001), а продолжительность бесплодия - для групп с MAR%IgG 50-59% и 100%.
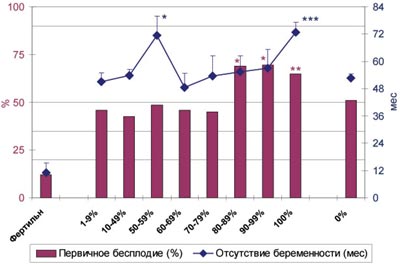
Рис. 1. Зависимость длительности и характера бесплодия от величины MAR%IgG (n=1066).
* - различия между бесплодными с АСАТ и без АСАТ достоверны с P<0,05; ** - c P<0,01; *** - c P<0,001.
Более низкие уровни АСАТ (MAR%IgG<50%) также нередко связаны с грубыми нарушениями сперматогенеза, качества спермы, изменениями в гормональной регуляции. Показано (табл.2), что при азооспермии наличие АСАТ является признаком обтурации, когда у мужчин при отсутствии сперматозоидов в эякуляте в большинстве случаев сохранены относительно нормальные размеры яичек и концентрация ФСГ. В группе больных с азооспермией без АСАТ, наоборот, у большинства (79%) имел место гипергонадотропный гипогонадизм. Причем, для азооспермии с наличием АСАТ характерно преобладание доли IgA-позитивных сперматозоидов над IgG-позитивными, что не наблюдается в других группах с иммунологическим фактором бесплодия. У больных с выраженной олигозооспермией (<5 млн/мл) средняя концентрация, процент прогрессивно-подвижных и морфологически нормальных сперматозоидов были сходными, однако содержание СГСГ у больных с АСАТ составлял 73% к контрольному уровню (Pt<0,05), что обеспечивало почти в полтора раза (143%) более высокую концентрацию свободного Т в периферической крови. Аналогичное увеличение концентрации свободного Т (Pt<0,05) за счет снижения содержания СГСГ имело место и у АСАТ-позитивных пациентов, концентрация сперматозоидов в сперме которых составляла от 5 до 19 млн/мл; одновременно у таких мужчин чаще имелось увеличение яичек и придатков.
| Показатели | азооспермия | конц. меньше 5 млн/мл | конц. от 5 до 19 млн/мл | |||
|---|---|---|---|---|---|---|
| С АСАТ | Без АСАТ | С АСАТ | Без АСАТ | С АСАТ | Без АСАТ | |
| Человек (число) | 11 | 22 | 41 | 72 | 68 | 94 |
| Возраст (лет) | 32,8.1,41 | 33,23.0,95 | 33,2.1,11 | 30,19.1,10 | 32,29.0,84 | 30,56.0,83 |
| Яички ( %) | <18** / >0 | <71 / >5 | 40/6 | 53/0 | 20/8 | 29/2 |
| Придатки ( %) | <18 / >58 | <52 / >23 | 29/37 | 31/16 | 12/31 | 20/23 |
| Варикоцеле (%) | 33 | 33 | 38 | 34 | 31 | 31 |
| ИРТ (%) | 50 | 25 | 33 | 37 | 36 | 30 |
| Конц. (млн./мл) | 0 | 0 | 1,57.0,22 | 1,73.0,18 | 12,68.0,53 | 12,31.0,37 |
| Подв. А+В (%) | 0 | 0 | 10,8.1,27 | 10,1.1,15 | 22,54.1,14 | 22,81.0,98 |
| Морфол. (%) | 0 | 0 | 42,72.3,55 | 44,71.1,98 | 32,28.1,54 | 37,58.1,46 |
| MAR IgG непр. (%) | 45,4.10,25 | 0 | 45,41.5,93 | 0 | 39,06.6,92 | - |
| MAR IgA непр. (%) | 55,0.5,00 | - | 34,17.8,60 | - | 7,88.1,47 | - |
| ЛГ (МЕ/л) | 7,20.1,61 | 7,07.0,92 | 6,37.0,98 | 6,62.0,51 | 4,67.0,51 | 4,35.0,31 |
| ФСГ (МЕ/л) | 9,20.3,84 | 12,85.2,23 | 7,90.1,17 | 7,10.0,70 | 5,32.0,49 | 5,26.0,37 |
| Т (пМ/л) | 14,91.1,91 | 15,48.1,47 | 16,85.1,37 | 17,97.1,09 | 19,14.1,62 | 20,07.0,88 |
| СГСГ (нМ/л) | 75,63.16,50* | 38,65.6,59 | 41,86.6,23 | 54,47.3,90 | 41,34.3,71** | 56,43.3,43 |
| Т свободный (пМ/л) | 22,35.6,52 | 44,09.9,71 | 53,81.10,64 | 42,61.4,45 | 56,09.7,60 | 39,16.4,08 |
Таблица 2. Особенности строения наружных половых органов, секреторная и эндокринная функция яичек у бесплодных мужчин с олигозооспермией на фоне АСАТ и без АСАТ в зависимости от концентрации сперматозоидов в эякуляте, M m и %.
Поскольку нарушения фертильности у MAR-позитивных мужчин могут быть связаны с ухудшением количественных показателей спермограммы, а не с действием АСАТ, были выделены выборки бесплодных пациентов с нормальной концентрацией, подвижностью и морфологией сперматозоидов, отличающиеся только по наличию и отсутствию АСАТ.
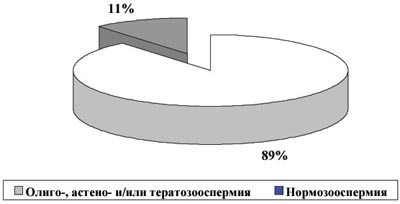
Рис. 2. Доля бесплодных пациентов с нормозооспермией без АСАТ (n=550)
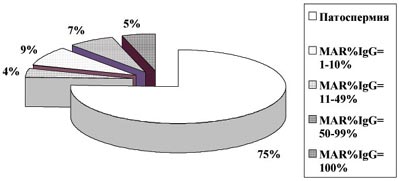
Рис. 3. Доля мужчин c нормозооспермией при иммунном факторе бесплодия (n=480)
Показано (рис.2 и 3), что нормальные количественные показатели спермограммы существенно чаще наблюдаются при бесплодном браке с аутоиммунными реакциями против сперматозоидов, чем у субфертильных мужчин без АСАТ (25% и 11% соответственно, P<0,0001). Имеются различия в продолжительности бесплодия и частоте первичных нарушений фертильности в группах с нормозооспермией, отличающихся только по наличию АСАТ (рис.4). Показано, что по сравнению с фертильными, продолжительность половой жизни без беременности существенно больше даже при MAR%IgG от 1 до 10% (P<0,05), и увеличивается при большем проценте АСАТ-позитивных сперматозоидов (P<0,001). Аналогично растет доля первичных нарушений репродуктивной функции, которые становятся статистически значимыми при MAR%IgG>50% (P<0,01). Тем не менее, даже у тех пациентов, у которых все сперматозоиды на момент обследования были покрыты АСАТ, беременности у жен или сексуальных партнерш до брака известны в 50% случаев (10/20).
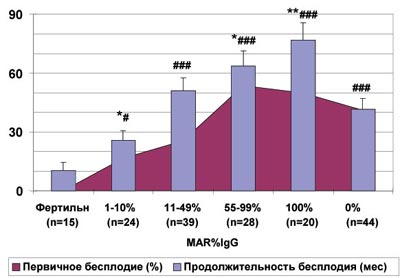
Рис. 4. Особенности нарушения репродуктивной функции у мужчин с нормозооспермией без инфекций репродуктивного тракта в зависимости от количества подвижных сперматозоидов, покрытых антиспермальными антителами (MAR%IgG).
* - различия между бесплодными с АСАТ и без АСАТ достоверны с P<0,05; ** - c P<0,01; # - различия между бесплодными и фертильными достоверны с P<0,05; ## - с P<0,01; ### - с P<0,001.
Данные закономерности подтвердил корреляционный анализ. Показано (рис.5), что у бесплодных мужчин с нормозооспермией имеется статистически значимая зависимость продолжительности бесплодия от количества подвижных сперматозоидов, покрытых антиспермальными антителами класса IgG. То, что связь является причино-следственной, подтверждает отсутствие в этой группе бесплодных мужчин значимой корреляции продолжительности бесплодия с другими показателями спермограммы: концентрацией сперматозоидов (r=0,00), их подвижностью (r=+0,11) и морфологией (r=+0,06), концентрацией лейкоцитов (r=-0,06), спонтанной и индуцированной ионофором акросомальной реакцией (r=+0,15 и -0,19 соответственно, P>0,05). С увеличением доли сперматозоидов, покрытых АСАТ класса IgA, также увеличивается продолжительность бесплодного брака; одновременно ухудшаются количественные показатели спермограммы, оцениваемые по интегральному индексу качества спермы (ИКС) - количеству прогрессивно-подвижных и морфологически нормальных сперматозоидов в эякуляте (рис.6).
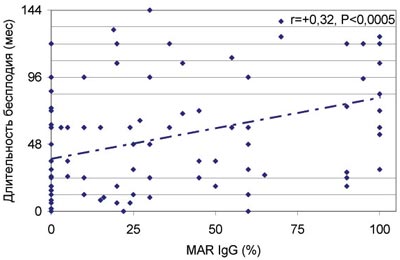
Рис. 5. Зависимость продолжительности бесплодия от количества подвижных сперматозоидов, покрытых антиспермальными антителами (MAR%IgG), при нормальной концентрации, подвижности и морфологии сперматозоидов в эякуляте (нормозооспермия) в отсутствие инфекций репродуктивного тракта.
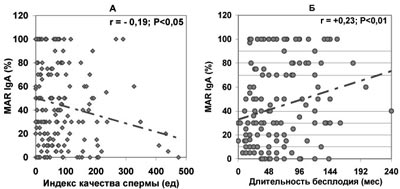
Рис. 6. Зависимость от величины MAR%IgA количества прогрессивно подвижных и морфологически нормальных сперматозоидов в эякуляте - ИКС (А) и продолжительности бесплодия при нормозооспермии (Б).
В то же время отсутствует значимая зависимость продолжительности бесплодия от доли всех живых сперматозоидов, покрытых АСАТ IgG, IgA, IgM (по данным ПЦМ), несмотря на то, что с ростом ПЦМ% наблюдается существенное ухудшение качества спермы (рис.7-9).
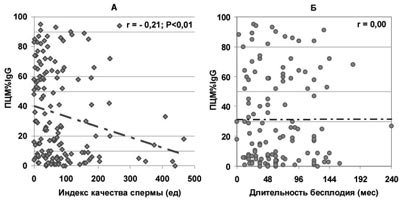
Рис. 7. Зависимость от величины ПЦМ%IgG количества прогрес-сивно-подвижных и морфологически нормальных сперматозоидов в эякуляте - ИКС (А) и продолжительности бесплодия при нормозооспермии (Б).
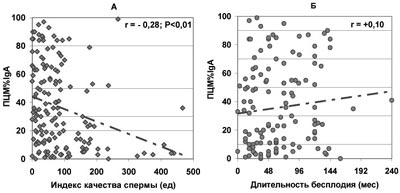
Рис. 8. Зависимость от величины ПЦМ%IgА количества прогрессивно подвижных и морфологически нормальных сперматозоидов в эякуляте - ИКС (А) и продолжительности бесплодия при нормозооспермии (Б).
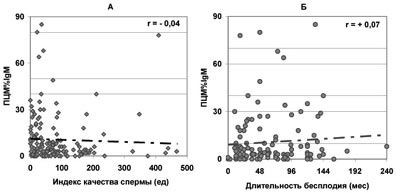
Рис. 9. Зависимость от величины ПЦМ%IgM количества прогрессивно подвижных и морфологически нормальных сперматозоидов в эякуляте - ИКС (А) и продолжительности бесплодия при нормозооспермии (Б).
При использовании стимулирующей терапии (кломифена цитртат по 50 мг/сут), традиционно применяемой для лечения гипо- и нормогонадотропных форм секреторного бесплодия, в случае присутствия АСАТ даже в небольших количествах наблюдается тенденция к увеличению MAR%IgG (табл.3). Имеется большой разброс индивидуальных значений MAR в процессе лечения: от снижения на -10% до увеличения на +70%. Количественные показатели спермограммы, за исключением доли сперматозоидов с быстро-поступательным движением (категория А), при этом остаются в пределах статистической ошибки.
| Показатели | Исходные | Лечение | MIN | MAX |
|---|---|---|---|---|
| Объем (мл) | 3.09.0.25 | 3.53.0.33 | -1.4 | +3.8 |
| Концентрация (млн/мл) | 60.5.12.6 | 75.5.11.2 | -56.0 | +117.7 |
| Подвижн. категории А (%) | 5.94.1.26 | 10.9.2.3* | -8.0 | +21.0 |
| Патологических форм (%) | 29.2.4.2 | 33.3.4.8 | -27.0 | +68.0 |
| MAR%IgG | 7.8.0.9 | 14.2.7.7 | -10.0 | +70.0 |
Таблица 3. Основные показатели спермограммы при стимуляции сперматогенеза антиэстрогенами (кломифена цитрат по 50 мг/сут) у мужчин с АСАТ, M.m (n=17)
* - различия до и на фоне лечения достоверны с P<0,05.
Таким образом, очевидно, что АСАТ являются патогенетически значимым фактором бесплодия, поскольку соответствуют основным критериям патологии [12]: являются относительно редким явлением с точки зрения статистики (18%), связаны с нарушением мужской репродуктивной функции и поддаются лечению.
Значительно более высокая частота случаев нормозооспермии при наличии АСАТ позволяет считать этот фактор патогенетически важным в отсутствие беременностей даже при нормальных количественных показателях спермограммы.
Наличие причинно-следственной связи между аутоиммунными реакциями к сперматозоидам и бесплодием также подтверждается рядом доказательств [12]. Во-первых, последовательностью событий во времени - наличие факта беременностей от мужчин с данной патологией в прошлом дает основание считать, что причина в форме развития аутоиммунных реакций предшествовала эффекту - развитию бесплодия. Во-вторых, статистически сильной связью (P<0,01-0,0005) между присутствием АСАТ и риском развития бесплодия. В-третьих, зависимостью эффекта от активности процесса - с ростом числа АСАТ-позитивных сперматозоидов ухудшаются как количественные показатели спермограммы [1-3, 17 и др.], так и продолжительность бесплодия, доля первичных нарушений и вероятность спонтанного наступления беременности, т.е. реальная фертильность. В-четвертых, эффект обратим - лечение приводит к снижению количества АСАТ и повышению вероятности наступления беременности [18, 19 и др.]. В-пятых, эффект биологически правдоподобен - описаны механизмы нарушения образования и функционирования сперматозоидов на фоне аутоиммунных реакций к ним, связанные с активацией фагоцитоза, избыточной продукцией активных радикалов кислорода, интерферонов и активацией комплемента по классическому пути [20-23].
Наши данные подтверждают, что наличие АСАТ на поверхности большинства сперматозоидов резко ухудшает прогноз на беременность. Это связано с нарушениями подвижности сперматозоидов и их проникновения в цервикальную слизь, преждевременной акросомальной реакцией, с чем, в частности связано, снижение вероятности оплодотворения яйцеклеткой даже in vitro [1-3, 24 и др.]. Даже повышение концентрации свободного Т, которое очевидно носит вторично-компенсаторный характер, не способно предотвратить ухудшение качества спермы.
Как показали представленные выше данные, вероятность наступления беременности статистически снижена даже когда не более 10% подвижных сперматозоидов покрыты АСАТ. При этом количественные показатели спермограммы - концентрация, подвижность и морфология сперматозоидов - могут быть как в пределах нормы (нормозооспермия), так и резко снижены. В последнем случае наиболее вероятной причиной ухудшения качества спермы будет двусторонняя обструкция семявыносящих путей (азооспермия), или односторонние нарушения проходимости, приводящие к более или менее выраженной патоспермии (олиго-, астено-, тератозооспермии). О преобладании обструкции и вторичного внетестикулярного повреждения сперматозоидов над первичными нарушениями сперматогенеза у мужчин с грубыми нарушениями качества спермы на фоне АСАТ свидетельствуют относительно нормальное строение яичек, придатков и физиологичные уровни гонадотропинов.
Как показало сравнение данных, полученных методами MAR и ПЦМ, только доля прогрессивно-подвижных сперматозоидов, покрытых АСАТ классов IgG и IgA отрицательно связаны с продолжительностью бесплодия. Общий процент живых клеток, покрытых IgG, IgA, IgM, имеет обратную корреляцию только с количественными показателями спермограммы. Определение АСАТ с помощью ИФА следует считать недостаточно чувствительным для первичного скрининга, что согласуется с данными литературы [2, 5, 6].
Использование терапии повышает шансы на беременность. Однако снижение величины MAR%IgG, например на фоне применения кортикостероидов, не сопровождается статистически значимым ростом числа беременностей, что показано в т.ч. нашими исследованиями [19, 25, 26]. С другой стороны, при любом способе лечения доля пациентов с исходно низким или высоким процентом АСАТ-позитивных сперматозоидов, от которых наступила беременность, остается примерно одинаковой. Следовательно, вероятность беременности зависит не только от величины MAR%IgG, но и неких других факторов, изучение которых должно продолжаться.
В целом, полученные данные и анализ литературы позволяют сделать вывод, что наличие аутоиммунных реакций против сперматозоидов всегда приводит к снижению вероятности наступления беременности. Нарушения качества спермы и реальной фертильности нарастают с увеличением доли АСАТ-позитивных сперматозоидов. Различия по сравнению с фертильными мужчинами статистически достоверны при любых значениях MAR% IgG>0%. По сравнению с бесплодными без АСАТ, в условиях равенства количественных показателях спермограммы, вероятность наступления беременности у АСАТ-позитивных мужчин становится достоверно меньше при MAR%IgG>50%. Вероятность наступления беременности в естественном цикле без лечения от мужчин с MAR%IgG>50% составляет менее 2%, а при MAR%IgG=100% практически равна 0. Исследование эякулята на наличие АСАТ является обязательным этапом диагностики бесплодных пар. Наличие АСАТ не характерно для хронического неспецифического простатита. Лечение бесплодных мужчин с аутоиммунными реакциями против сперматозоидов требует использования специальных методов лечения независимо от величины MAR%IgG>0%. Неспецифическая стимуляция сперматогенеза у мужчин с АСАТ приводит к усилению аутоиммунного процесса и ухудшению качества спермы.