Уважаемые пациенты! С 27 апреля клиника ЦИР на Новокузнецкой НЕ РАБОТАЕТ. Подробнее...
График. Онлайн-консультации. Оплата анализов онлайн. Анализы в другом городе.
Кафедра урологии МГМСУ (г.Москва)
НЦ акушерства, гинекологии и перинатологии РАМН (г.Москва)
Представлены данные клинико-лабораторного обследования 578 бесплодных мужчин с антиспермальными антителами (АСАТ), 550 пациентов без антител и 37 фертильных мужчин. Описано повышение у мужчин с АСАТ концентрации в крови и спонтанной продукции лейкоцитами in vitro интерферонов (ИФН), индуцированных (вирус Ньюкасла и ФГА) уровней ?- и ?-ИФН in vitro на фоне инфекций репродуктивного тракта. Изменения иммунитета характеризуются при этом увеличением количества лейкоцитов в сперме, НК-клеток и В-лимфоцитов в крови. Наблюдаемые изменения связаны с количеством АСАТ на сперматозоидах, и процессами их реорганизации, включая образование растворимых комплексов антиген-антитело. Отмечена фазная зависимость в изменениях системного иммунитета на фоне АСАТ: при MAR%IgG>50% увеличение количества АСАТ на сперматозоидах сопровождается вторичной иммуносупрессией: снижением концентрации Т-хелперов, НК- и В-лимфоцитов, гранулоцитов, ИФН в крови. Одним из механизмов иммуносупрессии является повышение концентрации в крови кортизола и свободного тестостерона. Влияние реакционноспособных метаболитов кислорода, ИФН, лизосомальных ферментов и повышенный фагоцитоз приводит к снижению количественных и качественных показателей спермы. Предполагаемым пусковым механизмом развития аутоиммунного процесса является экспрессия (появление) антигенов HLA классов I и II на сперматогенных клетках под действием ИФН и активация системы антигенпрезентирующих клеток.
Сегодня одна из 5-7 пар репродуктивного возраста во всем мире страдает бесплодием, и в половине случаев причиной этого является нарушение качества спермы у мужчины [1]. В 7 - 40% случаев причиной нарушения мужской репродуктивной функции являются антиспермальные антитела (АСАТ) [2-10].
Принято считать [11-13], что причиной образования АСАТ является нарушение баланса Т-хелперов и Т-супрессоров в органах репродуктивного тракта в сторону увеличения количества хелперов, что приводит к повышенной чувствительности к аутоантигенам сперматозоидов. Аналогичные сдвиги описаны и в реакциях системного иммунитета [14].
В качестве патогенетических факторов, приводящих к патоспермии, описана активация системы комплемента по классическому пути [15-17], но есть данные это опровергающие [18]. О возможной роли ?-интерферона (ИФН) в развитии экспериментального аутоиммунного орхита у сингенных мышей сообщали японские авторы [19].
Настоящее исследование выполнено с целью получить новые данные, характеризующие клинические, гормональные и иммунологические особенности мужчин с антиспермальным иммунитетом, раскрывающие патогенез данного заболевания.
Было проведено комплексное клинико-лабораторное обследование 367 пациентов с АСАТ и ретроспективный анализ историй болезни 211 пациентов (всего 578 человек), возраст которых колебался от 18 до 59 лет и в среднем составил 32,2.0,34 года. Группу сравнения составили: 1) 550 субфертильных мужчин без АСАТ, 2) 37 фертильных мужчин, жены которых наблюдались по поводу беременности 4-12 недель или спонтанных абортов.
У всех пациентов выполняли комплексный анализ эякулята в соответствии с критериями ВОЗ (1992, 1999). Методом MAR (mixed agglutination reaction) [20] вычисляли долю подвижных сперматозоидов, покрытых антителами IgG и IgA (MAR%), методом проточной цитофлуорометрии (ПЦМ) - процент живых сперматозоидов, покрытых антителами классов IgG, IgA, IgM и среднее количество АСАТ на один сперматозоид в условных единицах флуоресценции (У.Е.Ф.) [21].
Методом ИФА оценивали в периферической крови концентрацию ЛГ, ФСГ, пролактина (ПРЛ), тестостерона (Т), прогестерона (ПРГ), эстрадиола (Е2), кортизола (К), секс-гормон-связывающего глобулина (СГСГ), специфического антигена простаты (ПСА), методом ПЦМ - количество и соотношение различных популяций Т- и В-клеток, нефелометрическим методом - концентрацию иммуноглобулинов. По методу Кемпбелла определяли естественную и индуцированную продукцию интерферонов (ИФН), методом люминолзависимой хемилюминесценции - спонтанную и индуцированную продукцию фагоцитами реакционноспособных метаболитов кислорода. Диагностику инфекций репродуктивного тракта (ИРТ) осуществляли по наличию специфической ДНК методами ДНК-зондов и полимеразной цепной реакции (ПЦР), микрометодом ИФА, для условно-патогенных микроорганизмов - посевом на питательные среды.
Полученные данные обрабатывали методами вариационной статистики с использованием t критерия Стьюдента и F критерия Фишера для независимых и парных значений и Xi-квадрат, вычисляли коэффициент корреляции r.
Корреляционный анализ показал, что существует взаимосвязь между присутствием в сперме АСАТ и процентом сперматозоидов, покрытых антителами классов IgG, IgA и IgM с одной стороны, и рядом показателей системного иммунитета с другой. Для концентрации лейкоцитов в сперме, процента и концентрации В-лимфоцитов, концентрации ИФН в крови и стимулированных уровней ?-ИФН эта связь достоверна для всей выборки бесплодных мужчин репродуктивного возраста с MAR%IgG>0% (табл.1), что позволяет рассматривать их как патогенетически наиболее характерные. По данным ПЦМ (табл.4,5) в группе мужчин с установленным иммунологическим фактором бесплодия (MAR%IgG>0) имеется положительная корреляция между количеством АСАТ классов IgG, IgA и IgM на сперматозоидах и содержанием в крови НК-клеток (Pr<0,01), В-лимфоцитов (Pr<0,05), Т-супрессоров/цитотоксических лимфоцитов (Pr<0,01), лейкоцитов в сперме (Pr<0,01), отрицательная - с концентрацией всех Т-лимфоцитов (Pr<0,01) и Т-хелперов, в частности (Pr<0,01). Значения ряда показателей (сывороточный ИФН, количество Т-лимфоцитов и Т-хелперов и др.) связаны с процентом сперматозоидов, покрытых IgG, IgA и IgM, только в присутствии ИРТ. Более того, в некоторых случаях происходит инверсия связи: например, без ИРТ между процентом сперматозоидов, покрытых АСАТ класса IgM, и НК-клетками существует значимая положительная корреляция, при ИРТ - отрицательная (Pr<0,05).
| Показатели | Корреляция
(Pr<0,05-0,01) | Примечания | |
|---|---|---|---|
| Лейкоциты спермы (млн/мл) | + | Пациенты без ИРТ | |
| В-лимфоциты периферической крови (%) | ++ | Пациенты без ИРТ | |
| ++ | Все (включая ИРТ) | ||
| В-лимфоциты периферической крови (конц.) | ++ | Пациенты без ИРТ | |
| ++ | Все (включая ИРТ) | ||
| Интерфероны в крови (Ед/мл) | + | Все (включая ИРТ) | |
| ?-интерферон индуцированный in vitro митогеном ФГА (Ед/мл) | + | На фоне ИРТ | |
Таблица 1. Статистически значимая корреляция между наличием АСАТ на подвижных сперматозоидах (MAR%IgG) и показателями иммунного статуса у бесплодных мужчин репродуктивного возраста (n=429)
+ - корреляция достоверна с Pr<0,05, ++ - c Pr<0,01.
| Показатели | r | Примечания | |
|---|---|---|---|
| IgG (%) | Сывороточный ?- и ?-ИФН | -0,33* | в т.ч. с ИРТ (n=55) |
| Т-лимфоциты (CD3+) | +0,44* | при ИРТ (n=33) | |
| IgА (%) | Лейкоциты крови | -0,27* | в т.ч. с ИРТ (n=62) |
| Лимфоциты крови | -0,28* | - «» - | |
| Т-лимфоциты (CD3+) | -0,27* | - «» - | |
| Т-хелперы (CD4+) | -0,26* | - «» - | |
| IgМ (%) | Соотношение CD4/CD8 | +0,33* | в т.ч. с ИРТ (n=63) |
| IgA сыворотки крови | +0,29* | в т.ч. с ИРТ (n=58) | |
| НК-клетки (CD16+) | +0,39* | без ИРТ (n=39) | |
| НК-клетки (CD16+) | -0,41* | при ИРТ (n=30) | |
| Т-лимфоциты (CD3+) | +0,40* | при ИРТ (n=32) | |
Таблица 2. Статистически значимая корреляция между процентом АСАТ-позитивных живых сперматозоидов и показателями иммунного статуса у мужчин с иммунологическим фактором бесплодия.
* - различия статистически достоверны с Pr<0,05.
| Показатели | r | Примечания | |
|---|---|---|---|
| IgG (У.Е.Ф.) | Т-лимфоциты (CD3+) | -0,59** | без ИРТ (n=44) |
| НК-клетки (CD16+) | +0,46** | без ИРТ (n=44) | |
| Активность фагоцитов индуцированная (у.е.) | +0,79* | без ИРТ (n=8) | |
| Лейкоциты спермы (шт/мл) | +0,45** | без ИРТ (n=88) | |
| IgА (У.Е.Ф.) | Т-супрессоры/ цитотоксич. (CD8+) | +0,36* | без ИРТ (n=34) |
| IgМ (У.Е.Ф.) | Т-лимфоциты (CD3+) | -0,72** | без ИРТ (n=32) |
| Т-хелперы (CD4+) | -0,56** | - «» - | |
| В-лимфоциты (CD19+) | +0,37* | без ИРТ (n=32) | |
| Индуцированная активность фагоцитов (у.е.) | +0,67* | включая ИРТ (n=11) | |
Таблица 3. Статистически значимая корреляция между количеством АСАТ IgG, IgA и IgM на живых сперматозоидах и показателями иммунного статуса у мужчин с иммунологическим фактором бесплодия
* - различия статистически достоверны с Pr<0,05,** - с Pr<0,01.
| Показатели (млн/мл) | Пациенты с АСАТ | Пациенты без АСАТ | ||
|---|---|---|---|---|
| MAR IgG<10% | MAR IgG 10 - 49% | MAR IgG >=50% | ||
| n (человек) | 8 | 21 | 49 | 48 |
| Лейкоциты | 6,91.0,623
(5,4-10,0) | 6,62.0,606
(4,3-12,4) | 6,54.0,282#
(3,4-11,3) | 5,60.0,268
(3,5-9,7) |
| Лимфоциты | 2,07.0,231
(1,2-2,9) | 2,17.0,138
(1,4-3,8) | 2,14.0,091
(1,0-3,8) | 1,93.0,127
(1,0-3,4) |
| Т-лимфоциты (CD3) | 1,46.0,251
(0,53-2,35) | 1,43.0,097
(0,83-2,43) | 1,34.0,069
(0,59-2,56) | 1,26.0,091
(0,55-2,51) |
| Т-хелперы (CD4) | 0,78.0,159
(0,26-1,62) | 0,80.0,049
(0,53-1,33) | 0,77.0,043
(0,24-1,48) | 0,77.0,072
(0,28-1,70) |
| Т-супрессоры/ цитотоксич. (CD8) | 0,47.0,056
(0,26-0,65) | 0,56.0,043
(0,26-0,97) | 0,56.0,037
(0,15-1,19) | 0,48.0,044
(0,25-1,09) |
| НК-клетки (CD16) | 0,39.0,053
(0,17-0,67) | 0,34.0,043
(0,05-0,87) | 0,38.0,038#
(0,07-1,18) | 0,27.0,030
(0,07-0,80) |
| В-лимфоциты (CD19) | 0,15.0,032
(0,05-0,32) | 0,18.0,026
(0,06-0,53) | 0,24.0,029
(0,03-1,17) | 0,18.0,020
(0,05-0,58) |
Таблица 4. Концентрация лейкоцитов и их популяций в периферической крови больных с АСАТ без ИРТ при различном значении MAR%IgG (M.m/Min-Max)
# - различия между группой с АСАТ и контрольной группой достоверны с P<0,05.
Сравнение средних величин подтвердило (рис.1), что содержание ИФН в крови у мужчин с АСАТ существенно выше, а индуцированные вирусом Ньюкасла и ФГА in vitro уровни a- и ?-ИФН ИФН ниже, чем в группе мужчин без антител (Pt<0,05-0,001). Так же было показано (табл.4), что с увеличением доли MAR-позитивных сперматозоидов увеличивается концентрация в крови лейкоцитов и НК-клеток (Pt<0,05). Имеются различия (Pt<0,05) между группами в концентрации иммуноглобулинов (табл.5). Оценка активности макрофагов in vitro при опсонизации зимозана (рис.2) показала тенденцию к увеличению продукции активных метаболитов кислорода у мужчин с АСАТ при существенном снижении индуцированных уровней (Pt<0,05).
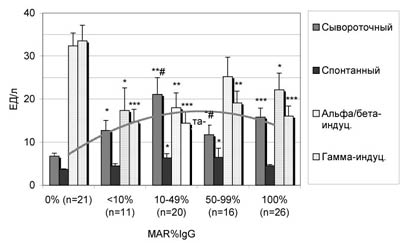
Рис. 1. Концентрация ИФН в крови, спонтанная и индуцированная вирусом Ньюкасла и ФГА продукция ИФН лейкоцитами in vitro в зависимости от активности антиспермального иммунитета, МЕ/л.
* - различия между группами с АСАТ и контрольной группой достоверны с P<0,05; *** - с P<0,001; # - различия между группами с АСАТ достоверны с P<0,05.

Рис. 2. Перикись-продуцирующая активность фагоцитов у бесплодных мужчин с АСАТ и без АСАТ, мВ/с.
* - различия между группами с АСАТ и без антител достоверны с P<0,05.
| Показатели (мг%) | Пациенты с АСАТ | Без АСАТ | ||
|---|---|---|---|---|
| MAR IgG<10% | MAR IgG 10 – 50% | MAR IgG >= 50% | ||
| IgG | 1364.191
(880-2122) | 1268.90
(718-2274) | 1361.60
(650-2397) | 1271.101
(560-2265) |
| IgA | 274.35
(180-363) | 207.20
(76-420) | 217.13
(69-430) | 189.19 (74-405) |
| IgM | 135.14*
(82-184) | 201.21
(50-400) | 150.9*
(78-300) | 158.20
(52-439) |
Таблица 5. Концентрация иммуноглобулинов в периферической крови больных с АСАТ без ИРТ при различном MAR%IgG (M.m/Min-Max)
* - различия между группами с различными уровнями АСАТ достоверны с P<0,05.
Обнаружено, что наблюдаемые изменения зависят не только от активности аутоиммунного процесса, традиционно оцениваемого по доле MAR- и ПЦМ-позитивных сперматозоидов, но и от количества АСАТ на каждой клетке, их реорганизации с образованием скоплений и удаления с поверхности мембраны. Ранее нами было показано [22], что процесс агрегации комплексов антиген-антитело в результате латеральных «сшивок» бивалентными антителами в условиях отсутствия дефицита или, наоборот, избытка АСАТ приводит к уменьшению флуоресценции АСАТ-позитивных клеток (как бы уменьшению количества АСАТ) и, в дальнейшем, переходу АСАТ-позитивных клеток в АСАТ-негативные за счет «шеддинга» таких иммунных комплексов в раствор. Оказалось, что при равном проценте MAR-позитивных клеток, покрытых IgG (не менее 50%), более сильное свечение образцов, интерпретируемое как большее число АСАТ на одну клетку, определяется у пациентов с существенным снижением (Pt<0,05-0,01) концентрации всех лимфоцитов, НК- и В-клеток в периферической крови по сравнению с меньшей плотностью АСАТ (рис.3). Снижены (Pt<0,05-0,01) при этом и индуцированные уровни ИФН (рис.4). Сравнение различных классов иммуноглобулинов показало, что в наибольшей степени такие изменения коррелируют с количеством АСАТ класса IgA.
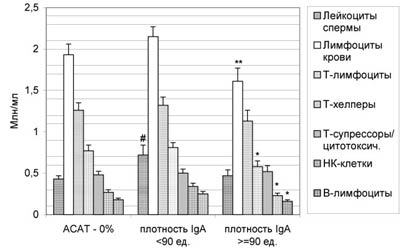
Рис. 3. Концентрация лейкоцитов в сперме, лимфоцитов и их различных популяций в периферической крови у мужчин с иммунологическим бесплодием (MAR%IgG не менее 50%) при отсутствии ИРТ в зависимости от плотности АСАТ класса IgA на сперматозоидах.
* - различия между группами с АСАТ достоверны с P<0,05, ** - с P<0,01; # - различия между контрольной и группами с АСАТ достоверны с P<0,05.
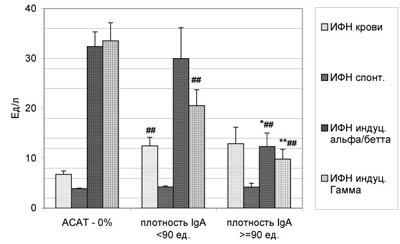
Рис. 4. Содержание ИФН в сыворотке крови, спонтанная и индуцированная вирусом Ньюкасла и ФГА активность лейкоцитов in vitro у мужчин с иммунологическим бесплодием (MAR%IgG не менее 50%) при отсутствии ИРТ в зависимости от плотности АСАТ класса IgA на сперматозоидах.
* - различия между группами с АСАТ достоверны с P<0,05, ** - с P<0,01; # - различия между контрольной и группами с АСАТ достоверны с P<0,05, ## - с P<0,01.
Гормональные исследования продемонстрировали увеличение содержания в крови мужчин с АСАТ К (рис.5) и свободного Т (рис.6). Показано, что повышение концентрации свободного Т более выражено у пациентов с нарушениями сперматогенеза в виде олигозооспермии и обеспечивается главным образом за счет уменьшения содержания в крови СГСГ. Роль продукции печенью СГСГ в нарушениях качества спермы у мужчин с иммунологическим фактором бесплодия подтвердил корреляционный анализ: существует положительная связь его концентрации с индексом качества спермы (ИКС) - общим числом прогрессивно-подвижных и морфологически нормальных сперматозоидов в эякуляте (r=+0,39 при +0,29 в группе без АСАТ, Pr<0,05). В то же время, у пациентов с АСАТ отсутствует значимая обратная зависимость между концентрацией ФСГ и качеством спермы (r=-0,15, Pr>0,05), характерная для бесплодных мужчин без АСАТ (r=-0,21, Pr<0,05). При равном и нормальном содержании ФСГ в периферической крови (4,25-6,25 мМЕ/мл при норме от 1,1 до 9,4 мМЕ/мл) основные показатели спермограммы у бесплодных мужчин с MAR%IgG>50% существенно лучше не только пациентов с идиопатическим бесплодием, но и мужчин, у которых MAR%IgG<50% (рис.7).
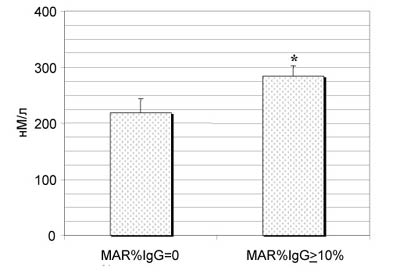
Рис. 5. Концентрация кортизола в периферической крови у бесплодных пациентов без олигозооспермии с АСАТ (n=18) и без антител (n=15).
* - различия между группами достоверны с P<0,05.

Рис. 6. Особенности регуляции синтеза андрогенов у бесплодных мужчин с различной активностью антиспермального иммунитета на фоне олигозооспермии.
** - различия между группами с АСАТ и без АСАТ достоверны с P<0,01.
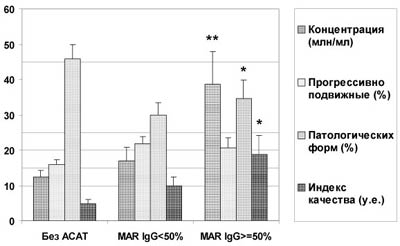
Рис. 7. Параметры спермограммы при одинаковой концентрации ФСГ (4,25-6,25 мМЕ/мл) в сыворотке периферической крови у пациентов с идиопатическим бесплодием (n=30), умеренным (n=21) и высоким (n=16) процентом подвижных АСАТ-позитивных сперматозоидов.
* - различия между группами с АСАТ и без АСАТ достоверны с P<0,05, ** - с P<0,01.
Хотя ИРТ являются наиболее часто диагностируемым этиопатогенетическим фактором иммунологического мужского бесплодия (48%), АСАТ имеются только у 1/3 инфицированных хламидиями, мико- или уреаплазмами, что предполагает наличие неких дополнительных предрасполагающих факторов. Установлено, что присутствие в репродуктивном тракте инфекций, таких как Chlamydia trachomatis, Ureaplasma urealyticum, Mycoplasma hominis, приводит к повышению концентрации ИФН в сыворотке крови и снижению резервных возможностей лейкоцитов по сравнению с нормой у всех мужчин (рис.8). Однако, в группах пациентов с MAR%IgG>50% индуцированные in vitro уровни ?/?- и ?-ИФН существенно выше, чем в группах с более низким процентом АСАТ-позитивных сперматозоидов и без антител (Pt<0,05-0,01). Поскольку частота встречаемости различных ИРТ в выделенных группах примерно одинакова (табл.6), наблюдаемые различия следует считать связанными с присутствием АСАТ.
| Показатели | АСАТ на фоне ИРТ | ИРТ без АСАТ | ||
|---|---|---|---|---|
| MAR IgG < 10 % | MAR IgG 10-49% | MAR IgG >=50% | ||
| Число больных (n) | 27 | 37 | 50 | 195 |
| Chlamydia trachomatis | 59,1 | 57,9 | 48,0 | 49,7 |
| Ureaplasma urealyticum | 47,8 | 61,8 | 64,0 | 64,8 |
| Mycoplasma hominis | 36,8 | 21,9 | 20,0 | 26,1 |
| Trichomonas vaginalis | 3,7 | 2,7 | 0,0 | 0,9 |
| Бактериоспермия (больше 1000 кол/мл) | 11,1 | 18,9 | 6,0 | 11,3 |
| ВПГ 1 и 2 (%) | 22,2 | 29,4 | 14,0 | 38,8 |
Таблица 6. Встречаемость бессимптомно протекающих ИРТ в группах бесплодных мужчин с различными уровнями АСАТ, %.
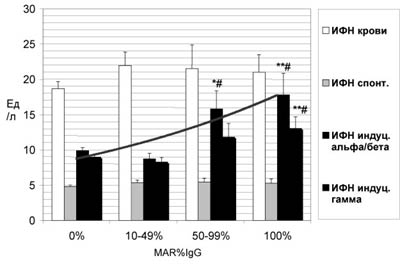
Рис. 8. Интерфероновый статус у бесплодных мужчин с ИРТ при различных значениях MAR%IgG.
* - различия между группами с различными уровнями АСАТ достоверны с P<0,05 ** - с P<0,01, # - различия между пациентами с АСАТ и контрольной группой достоверны.
Корреляционный анализ показал (табл.7), что на фоне ИРТ достоверная зависимость между титрами ИФН и АСАТ (MAR%IgG) наблюдается только в присутствии Chlamydia trachomatis, и касается индуцированных in vitro уровней ?/?-ИФН (P<0,05) и ?-ИФН (P<0,01).
| ИРТ (моно-инфекция) | n | ИФН сыв. | ИФН спонт. | ?/?-ИФН индуц. | ?-ИФН индуц. |
|---|---|---|---|---|---|
| Chlamydia trachomatis | 185 | 0,04 | -0,03 | +0,17* | +0,26** |
| Ureaplasma urealyticum | 283 | 0,08 | 0,01 | 0,11 | 0,12 |
| Mycoplasma hominis | 283 | 0,08 | 0,01 | 0,11 | 0,12 |
Таблица 7. Корреляционная зависимость между MAR%IgG и показателями интерферонового статуса у мужчин с иммунологическим фактором бесплодия в присутствии различных ИРТ, r.
* - различия статистически достоверны с Pr<0,05,** - с Pr<0,01.
Показано, что на фоне ИРТ у мужчин с количеством АСАТ на каждом сперматозоиде больше среднего снижено содержание ряда иммунокомпетентных клеток: лейкоцитов в сперме (P<0,01), НК-клеток (P<0,05) и В-лимфоцитов (P<0,05) в крови (рис.9).
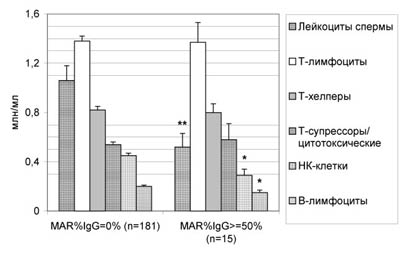
Рис. 9. Концентрация лейкоцитов спермы и различных субпопуляций лимфоцитов периферической крови у мужчин с высокой активностью антиспермального иммунитета (MAR%IgG>=50%, плотность АСАТ класса IgG>=80 ед.) и без АСАТ на фоне субклинических ИРТ.
* - различия между группами с АСАТ и без АСАТ достоверны с P<0,05, ** - с P<0,01.
Предполагается [23,24] несколько путей развития аутоиммунитета: 1) микробные антигены могут стимулировать аутореактивные В- и Т-клетки за счет молекулярной мимикрии; 2) некоторые вирусы, например Эпштейна-Барр, и липополисахариды могут непосредственно стимулировать В-клетки; 3) как следствие предшествовавших нарушений в органах-мишенях и 4) в результате нарушений регуляции в цитокиновой сети, неадекватной экспрессии МНС (HLA) и недостаточной эндокринной супрессии.
Роль механических травм яичек и иных повреждений, приводящих к нарушению гемато-тестикулярного барьера, а так же перекрестных реакций с микроорганизмами обсуждена нами выше в первой части настоящей статьи. Представленные здесь данные позволяют охарактеризовать особенности регуляции иммунной и эндокринной систем у мужчин с АСАТ.
Принципиально важным мы считаем установление факта, что у пациентов с АСАТ на фоне ИРТ оказались существенно повышенными сывороточные и индуцированные in vitro уровни ?, ? и ?-ИФН. В присутствии Chlamydia trachomatis между MAR%IgG и индуцированными уровнями ?, ? и ?-ИФН существует достоверная позитивная корреляция. Пропорционально доле АСАТ-позитивных сперматозоидов достоверно повышена концентрация ИФН и в отсутствии ИРТ. Корреляционный анализ всей выборки бесплодных мужчин с MAR%IgG>0% подтвердил, что повышенная концентрация ИФН в крови и более высокие уровни в ответ на ФГА (?-ИФН) характерны для всех пациентов с иммунологическим фактором бесплодия. Это позволяет предположить продукцию ИФН не только патогенетически значимым, но возможно и тригерным (пусковым) механизмом, обусловливающим все прочие иммунологические реакции, характерные для мужчин с АСАТ.
Известно [23-25], что продукция ИФН является универсальной реакцией на попадание в организм различных микроорганизмов, в первую очередь с внутриклеточным циклом развития: вирусов, хламидий, микоплазм, рикетсий и др. Интерфероны обладают комплексом иммуномодулирующих свойств, и одним из важных механизмов их действия является повышение экспрессии антигенов главного комплекса гистосовместимости (MHC или HLA) классов I и II на всех клетках, в результате чего улучшается распознавание инфицированных, малигнизированных и/или чужеродных (трансплантат) клеток макрофагами и развитие специфического иммунного ответа [23-25]. Гиперпродукцией ИФН, приводящей к активному синтезу молекул МНС класса II на ?-клетках поджелудочной железы и тироцитах щитовидной железы объясняют их деструкцию при диабете I типа и тиреоидите Хасимото [23]. Чрезмерное повышение концентрации ИФН на фоне ИРТ и при других неблагоприятных воздействиях (стресс, гипертермия, травмы и др.) может нарушить иммунопривилегированность мужских половых гамет, которая обеспечивается не только изолирующей функцией ГТБ, но и почти полным отсутствием на мембране развивающихся сперматогенных клеток антигенов HLA обоих классов [26-30]. В последние годы установлено, что, несмотря на минимальное количество антигенов HLA на поверхности сперматозоидов в норме, имеется высокий уровень транскрипции этих генов, т.е. отсутствие экспрессии белков HLA на половых клетках является результатом посттранскрипционной регуляции [31-34]. Поэтому под действием ИФН может начаться экспонирование белков HLA-комплекса, что приведет к развитию аутоиммунного процесса. Экспрессии молекул МНС класса II на поверхности клеток самой по себе недостаточно для активации непримированных аутореактивных Т-клеток, но она может быть необходимой для того, чтобы клетка стала мишенью для примированных аутореактивных Т-хелперов. In vitro было показано [35], что высокоочищенные сперматогенные клетки вызывали пролиферацию смеси лимфоцитов при их совместном инкубировании только в том случае, если и сперматозоиды и воспринимающие клетки экспонировали комплекс HLA-DR. Хотя у здоровых мужчин, как показали японские и английские авторы [36,37], ИФН in vitro не вызывает дополнительной экспрессии HLA классов I и II на сперматозоидах, определенную роль в этом могут играть наследственные факторы. Из экспериментальных исследований известно, что «у предрасположенных к аутоиммунным заболеваниям линий ?-ИФН легче индуцирует экспрессию молекул МНС класса II на клетках мишенях, чем у животных невосприимчивых линий» [23, с.521]. По данным клинических исследований известно, что выработка АСАТ ассоциирована с несколькими кластерами HLA-I и II: А28, В22, A1 в отсутствие А9 и С3, DR4, DR6, DQ7 [38-43], хотя некоторые авторы это отрицают [44].
Существует ещё два возможных пути развития аутоиммунитета, обусловленного ИФН. Более 10 лет назад S.S.Witkin [45] указал, что развитие антиспермального иммунитета у женщин может быть связано с экспрессией под действием ?-ИФН антигенов класса I на макрофагах и следующим за этим узнаванием Т-хелперами процессированных антигенов сперматозоидов. Роль ИФН в патогенезе женского бесплодия, связанного и не связанного с образованием изо-АСАТ, подтверждена в последние годы [46,47]. У мужчин аналогичное повышение функциональной активности макрофагов за счет ауто- и паракринной регуляции посредством ИФН может так же стать фактором развития аутоиммунного процесса. Важно в этой связи, что гранулоциты и макрофаги спермы в норме участвуют не только в защите от инфекций, но и выполняют функцию контроля качества спермы, устраняя морфологически ненормальные гаметы [48-50]. Т.е. фагоцитоз сперматозоидов - естественный и постоянный процесс, происходящий в дополнительных половых железах и сперме. Экспонирование переработанных антигенов сперматозоидов на фоне повышенной экспрессии макрофагальных антигенов HLA-DR и гиперпродукция ИФН-? могут являться механизмом развития аутоиммунитета.
С другой стороны, было показано [51-53], что сперматозоиды могут связываться с соматическими клетками, имеющими на своей поверхности HLA-DR, и это является одним из механизмов передачи ВИЧ. А экспрессия на соматических клетках, таких как эндотелиоциты, фибробласты и некоторые другие комплекса HLA класса II происходит под действием ?-ИФН [25]. S.R.Erlander [54] высказал предположение, что сперматозоиды таким образом могут вызывать аутоиммунные реакции как в присутствии, так и в отсутствие ВИЧ.
Возможно, при гиперпродукции ИФН экспрессия антигенов HLA-комплекса сперматозоидов, фагоцитов и соматических клеток происходит одновременно. Уточнение роли каждого из этих процессов требует продолжения исследований.
Одновременно происходит рост локальной концентрации лейкоцитов, пропорциональной суммарному количеству сперматозоидов, покрытых АСАТ и их количеству на одну клетку по данным ПЦМ, что согласуется с результатами T.Gil et al. [56]. Увеличение концентрации в сперме лейкоцитов в отсутствии ИРТ можно считать характерным признаком аутоиммунного процесса в репродуктивной системе. Эту точку зрения разделяют ряд авторов [42,57]. В норме в сперме содержатся 50-60% гранулоцитов, 20-30% макрофагов и 2-5% Т-лимфоцитов [58]. Одним из механизмов увеличения концентрации лейкоцитов в сперме и крови, очевидно, является описанное увеличение продукции и концентрации ИФН. Другим возможным механизмом - нарушение нормального соотношения между хелперными и супрессорными лимфоцитами: показано, что в сперме фертильных мужчин преобладают Т-супрессоры/цитотоксические лимфоциты [12], но у пациентов с АСАТ это наблюдается не всегда [13]. Однако пиоспермия имеется не у всех больных с АСАТ - по нашим данным не более чем у 20% [5],- что объясняет выводы ряда авторов об отсутствии связи между концентрацией лейкоцитов в сперме и АСАТ [48,50,59,60].
Учитывая увеличение концентрации ИФН в крови и продукции фагоцитами активных радикалов кислорода in vitro, а также описанное нами ранее снижение рН семенной плазмы [5] и повышение в 3,34 раза уровня генерации свободных радикалов кислорода в эякуляте у АСАТ-позитивных мужчин [61] можно считать, что данные реакции являются факторами, непосредственно приводящими к патоспермии. Повреждающее действие ИФН и перекисных радикалов на подвижность спермы in vitro уже были описаны в литературе [62,63], но без учета наличия АСАТ. Возможно, ИФН является одним из факторов, индуцирующих преждевременную акросомальную реакцию, описанную нами на фоне АСАТ [5], поскольку D.G.Dimitrov и M.Petrovska [64] показали, что супернатант активированных КонА лейкоцитов и рекомбинантный ИФН-? существенно повышали процент спонтанно претерпевших акросомальную реакцию сперматозоидов. Повреждающим фактором так же может являться активация комплемента по классическому пути [16,17], что, однако, наблюдается не у всех мужчин с АСАТ [18]. Возможно, изменения активности комплемента у мужчин с АСАТ зависит от образования растворимых комплексов антиген-антитело [22,65]. Известно [23], что при избытке антигена образующиеся иммунные комплексы имеют небольшие размеры и приводят к падению общего содержания комплемента.
Важным является обнаружение фазной зависимости показателей иммунного и интерферонового статусов от степени активности антиспермального иммунитета и процессов реорганизации комплексов антиген-антитело. Это объясняет отсутствие строгой корреляции между показателями антиспермального и системного иммунитета и противоречивость данных литературы [2,3,11,12,13,14,55]. С ростом процента АСАТ-позитивных сперматозоидов количество лейкоцитов, НК- и В-лимфоцитов в целом возрастает, что согласуется с данными ряда исследователей [2,3,11,14,55], но при количестве антител на каждом сперматозоиде больше среднего (80-100 У.Е.Ф.) содержание этих клеток становится меньше при равных значениях MAR% в выделенных группах. Снижается при этом и способность продуцировать лейкоцитами ?- и ?-ИФН в ответ на индукторы (вирус Ньюкасла и ФГА). Между MAR% и ПЦМ% с одной стороны и долей и количеством всех Т-лимфоцитов и Т-хелперов существует значимая отрицательная корреляция. В наибольшей степени снижение зависит от количества АСАТ класса IgM на каждом сперматозоиде: r=-0,72 и -0,56 соответственно. Это дает основание говорить о вторичной иммуносупрессии, которая наблюдается у мужчин с высокими уровнями АСАТ как в отсутствие ИРТ, так и на фоне инфекций.
Наличие иммуносупрессии подтверждают данные гормональных исследований: увеличение на 1/3 концентрации К и почти в 3 раза свободного Т по сравнению с контрольными пациентами без АСАТ. При этом концентрация общего Т существенно не отличается от контроля, что согласуется с данными литературы [66,67]. Биологическое значение повышения концентрации свободного Т, очевидно так же как и для К, сводится к обеспечению локальной иммуносупрессии, необходимой для поддержания сперматогенеза в условиях развития антиспермального иммунитета и предотвращения аутоиммунной деструкции органа под действием АСАТ. На модели экспериментального орхита в наших исследованиях было показано [68], что в группе леченных животных с сохранившимся сперматогенезом соотношение Т/Е2 было больше в 8 раз по сравнению с контрольными, у которых произошла атрофия органа. Физиологическую роль Т, как эндогенного иммуносупрессора, косвенно подтверждают данные об инволюции яичек в результате развития аутоиммунного орхита у животных с сезонным сперматогенезом [69].
Гормональные исследования также подтвердили высказанную ранее точку зрения [5], что оценка только процента подвижных сперматозоидов, покрытых АСАТ (методы MAR и IBT) не отражает реальной активности аутоиммунного процесса и степени нарушения сперматогенеза. При нормальной и равной концентрации ФСГ показатели спермограммы в группе пациентов с MAR%IgG<50% существенно лучше не только по сравнению с бесплодными без АСАТ, но с теми, MAR%IgG у которых не превышал 50%. Это означает, что у мужчин с большим процентом АСАТ-позитивных сперматозоидов сохранены относительно нормальные взаимосвязи по оси гипоталамус-гипофиз-гонады.
Возможно, с увеличением концентрации свободного Т связано повышение секреции ПСА и размера простаты по данным пальцевого ректального исследования у пациентов с АСАТ (см. часть 1). С другой стороны, это может быть следствием неспецифического аутоиммунного воспаления, сопровождающегося отеком железы, вызванного присутствием АСАТ-позитивных сперматозоидов и перекрестных реакций с тканями железы [3], и даже отложением в ткани иммунных комплексов.
Таким образом, полученные данные и анализ научных публикаций позволяют сделать вывод, что важными патогенетическими механизмами при мужском иммунном бесплодии являются:
Благодарность: авторы выражают благодарность сотрудникам лаборатории клиничесой иммунологии НЦ А,ГиП РАМН (руководитель - проф. Г.Т.Сухих) к.м.н. Голубевой Е.Л., к.б.н. Жданову А.В., к.м.н Киявской Д.Л., к.б.н. Логиновой Н.С., к.б.н. Матвеевой Н.К., к.б.н. Николаевой М.А., к.б.н. Файзулину Л.З., асп. Коротковой И.В. и другим, выполнявшим лабораторные тесты, данные которых использованы в настоящей статье.